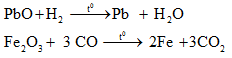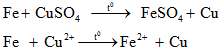2.1. Nguyên tắc điều chế kim loại
- Là sự khử ion kim loại thành kim loại: \({M^{n + }} + ne \to M\)
2.2. Phương pháp điều chế kim loại
a. Phương pháp nhiệt luyện
- Dùng chất khử như C,CO,H2, hoặc kim loại hoạt động để khử ion kim loại ra khỏi hợp chất ở nhiệt độ cao.
- Chú ý:
+ Phương pháp này thường được sử dụng trong công nghiệp
+ Dùng để điều chế các kim loại trung bình, yếu như: Zn, Fe, Sn, Pb,...
b. Phương pháp thủy luyện
- Dùng chất khử mạnh Zn, Fe,..để khử kim loại có tính khử yếu hơn trong dung dịch ra khỏi hợp chất.
Chú ý:
+ Cơ sở phương pháp này là dùng những dung dịch thích hợp như H2SO4, NaOH, NaCN,..để hoà tan kim loại hoặc hợp chất kim loại và tách ra khỏi phần không tan.
+ Không dùng kim loại kiềm, kiềm thổ để khử.
c. Phương pháp điện phân
- Điện phân hợp chất nóng chảy: Dùng để điều chế các kim loại mạnh như Na, K, Mg, Ca, ...
Ví dụ: Điều chế NaCl nóng chảy thu được Na theo pthh
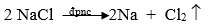
- Điện phân dung dịch: Dùng điều chế các kim loại trung bình, yếu bằng cách điện phân dung dịch muối của chúng.
Ví dụ: Điện phân dung dịch CuCl2 thu được Cu theo pthh
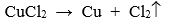
- Tính lượng chất thu được ở mỗi điện cực. Dựa vào định luật Faraday: \(m=\frac{A.I.t}{n.F}\)
+ m: Khối lượng chất thu được mỗi điện cực (gam)
+ A: Khối lượng mol nguyên tử của chất thu được ở điện cực
+ n: Số electron mà nguyên tử hoặc ion đã cho hoặc nhận
+ I: Cường độ dòng điện ampe kế (A)
+ t: Thời gian điện phân (giây)
+ F: hằng số Faraday (F = 96500)