1.1. Các nguyên tố hóa học
– Có khoảng 20 – 25 % các nguyên tố hóa học tồn tại trong tự nhiên là các nguyên tố cần thiết cho sinh vật.
Ví dụ: cơ thể người cần khoảng 25 nguyên tố.
– Dựa vào tỉ lệ phần trăm khối lượng cơ thể, các nguyên tố trong cơ thể sinh vật được chia thành hai nhóm: Đại lượng (còn gọi là đa lượng) và vi lượng. Các nguyên tố đại lượng chiếm lượng lớn trong cơ thể con các nguyên tố vi lượng chiếm lượng rất nhỏ, thưởng nhỏ hơn 0,01 % khối lượng cơ thể
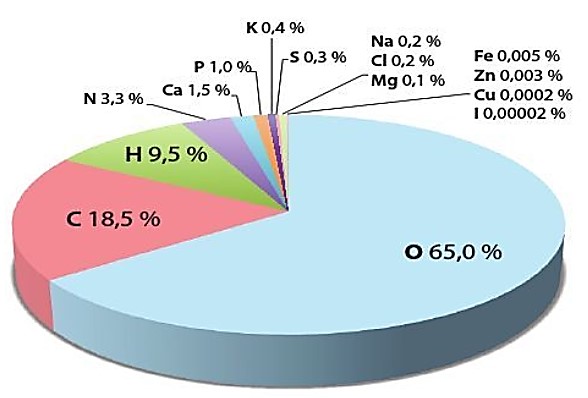
Hình 5.2. Tỉ lệ phần trăm một số nguyên tố tròn cơ thể người
– Các nguyên tố C, H, O, N là thành phần chủ yếu cấu tạo nên các hợp chất chính trong tế bào như nước, carbohydrate, lipid, protein và nucleic acid. Nguyên tố P là thành phần quan trọng của adenosine triphosphate (ATP) và nucleic acid còn nguyên tố S tham gia cấu tạo protein
– Các nguyên tố vi lượng mặc dù chiếm lượng rất nhỏ nhưng rất cần thiết cho hoạt động của tế bào và cơ thể.
Ví dụ: Nguyên tố Fe chỉ chiếm 0,005 % khối lượng cơ thể người nhưng là thành phần không thể thiếu của hemoglobin trong hồng cầu với chức năng vận chuyển (nguyên tố Zn, Cu tham gia cấu tạo nhiều loại enzyme…Nếu cơ thể thiếu một số nguyên tố đại lượng (Ca, P. Mg,…) và vi lượng có thể gây ra một số rối loạn về chuyển hóa và bệnh

Hình 5.3. Một số bệnh ở người và thực vật do thiếu nguyên tố đại lượng và vi lượng
|
– Nguyên tố đại lượng chiếm lượng lớn trong cơ thể sinh vật (C, H, O, N, P, S…) và cấu tạo nên các hợp chất chính trong tế bào. – Nguyên tố vi lượng chiếm lượng rất nhỏ nhưng lại rất cần thiết cho hoạt động của tế bào và cơ thể (Fe là thành phần quan trọng của hemoglobin; Zn, Cu tham gia cấu tạo nhiều loại enzyme…) |
|---|
b. Cacbon
Carbon có bốn electron tự do tham gia liên kết cộng hóa trị với các nguyên tử carbon khác và các nguyên tử khác như O,N,P. Do vậy chỉ các nguyên tử carbon mới có thể tạo nên mạch “xương sống” của các hợp chất hữu cơ chính có trong tế bào như protein, nucleic acid, carbohydrate, lipid.
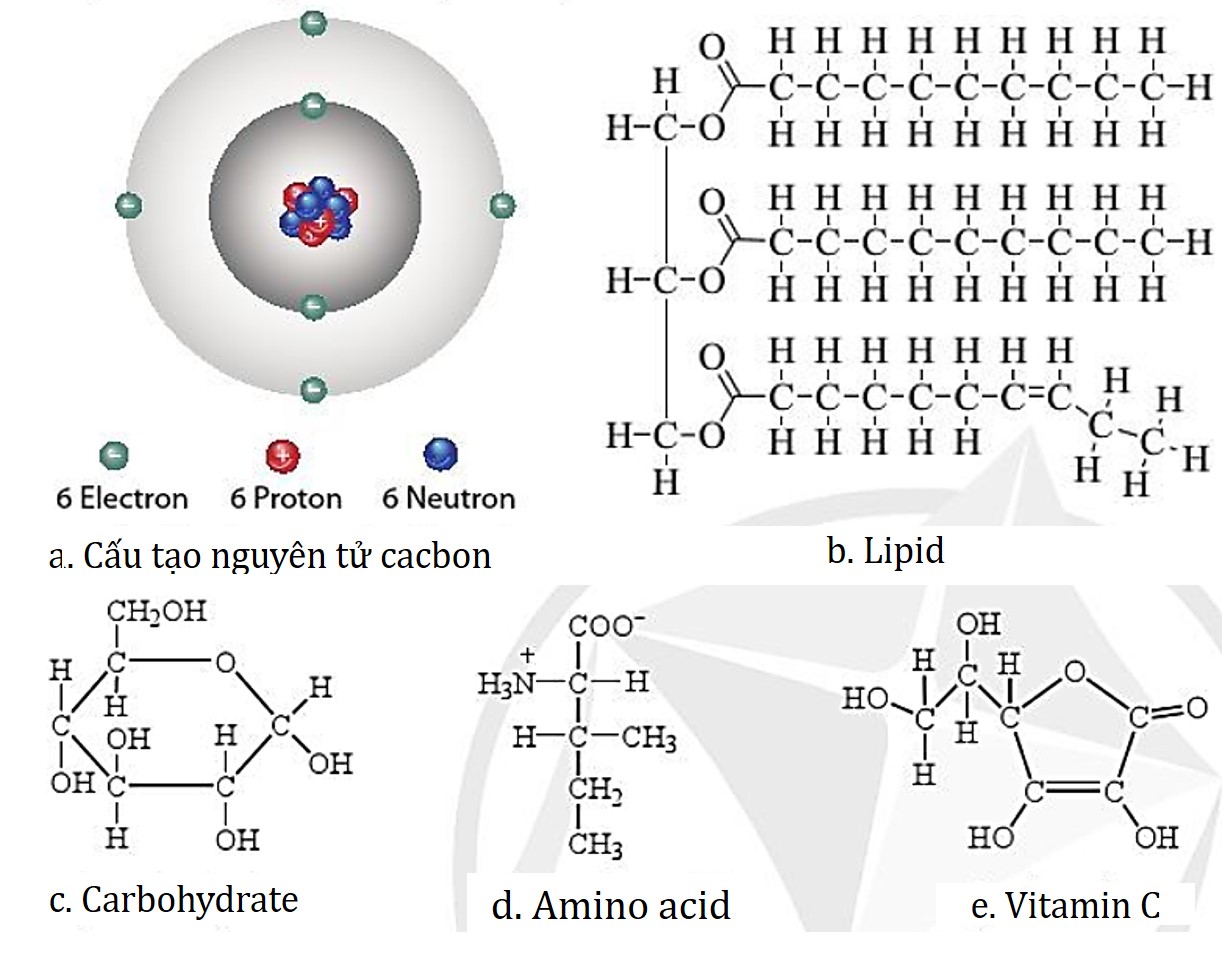
Hình 5.4. Carbon trong cấu trúc một số hợp chất
|
Carbon tạo nên mạch “xương sống” của các hợp chất hữu cơ trong tế bào và tạo nên sự đa dạng về cấu trúc của các hợp chất. |
|---|
1.2. Nước
a. Cấu tạo hoá học và tính chất vật lí, hoá học của nước
– Trong phân tử nước, nguyên tử O có khả năng hút cặp electron mạnh hơn tạo nên liên kết phân cực với nguyên tử H Nguyên tử O mang một phần điện tích âm và nguyên tử H mang một phần điện tích dương. Cấu tạo này giúp các phân tử nước dễ dàng liên kết với nhau và với nhiều phân tử khác bằng liên kết hydrogen làm cho nước có những tinh chất độc đạo. Ví dụ nước là dung môi hoả tan nhiều chất, nước có nhiệt bay hơi cao, sức căng bề mặt lớn so với nhiều dung môi hoa học khác.
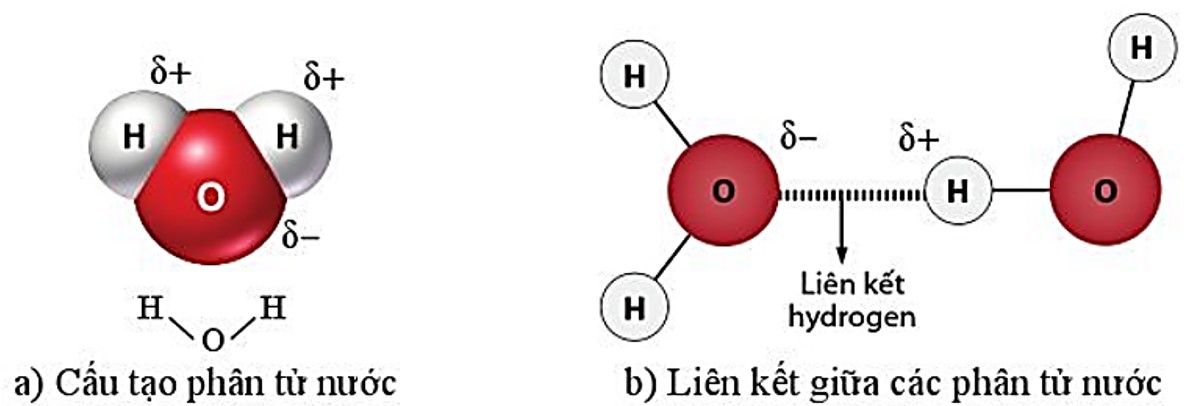
Hình 5.5. Mô hình phân tử nước (\(\delta \)– mang một phần điện tích âm, \(\delta \)+: mang một phần điện tích dương)
b. Vai trò của nước
– Nước chiếm khoảng 70 – 90 % khối lượng tế bào và còn là thành phần chính của dịch gian bảo, huyết tương, dịch khớp…
– Nước là “dung môi của sự sống”. Nước có thể hòa tan nhiều hợp chất như muối, đường, protem…
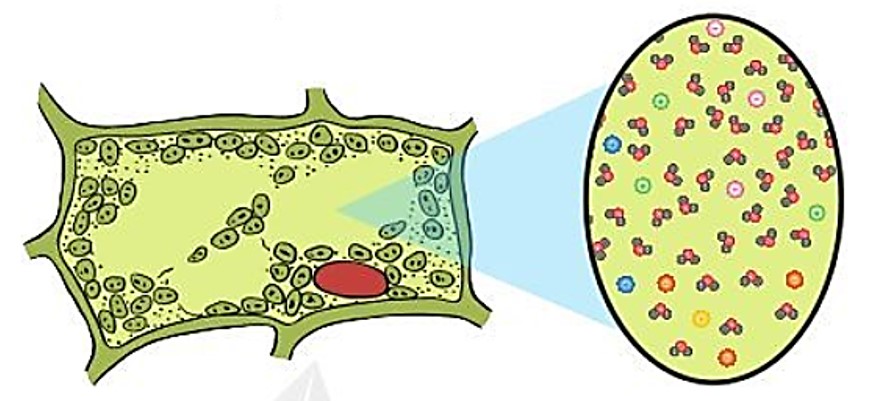
Hình 5.6. Nước là dung môi hòa tan các chất
– Sự phá vỡ và hình thành các liên kết hydrogen giữa các phân tử nước dẫn đến nước có khả năng hấp thụ và thải ra một lượng nhiệt lớn. Khi nước bay hơi và ngưng tụ giúp tế bảo và cơ thể thải nhiệt (hình 5.7).
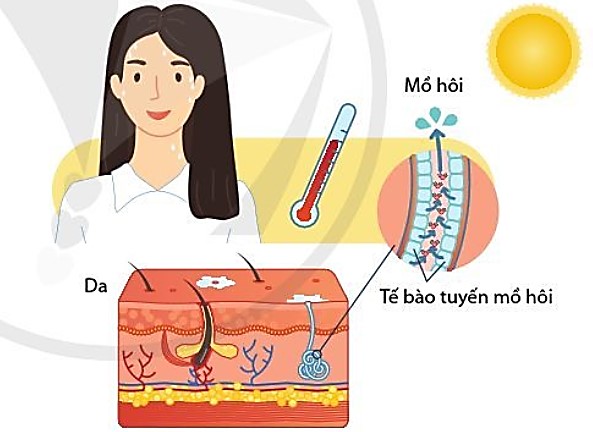
Hình 5.7. Nước đóng vai trò điều hòa thân nhiệt cơ thể.
|
Nước chiếm khoảng 70 90 % khối lượng tế bào. Nước là phân tử phân cực có khả năng hình thành liên kết hydrogen với nhau và với nhiều hợp chất khác. → Do vậy, nước là dung môi hòa tan nhiều hợp chất; làm môi trường phản ứng và môi trường vận chuyển; tham gia trực tiếp vào nhiều phản ứng hóa học; đóng vai trò điều hòa nhiệt độ tế bào và cơ thể. |
|---|