2.1. Nguyên tắc nhận biết ion trong dung dịch
Dung dịch chứa ion + Thuốc thử:
– Chất kết tủa
– Sản phẩm có màu
– Chất khí khó tan sủi bọt
– Chất khí bay khỏi dung dịch
2.2. Nhận biết một số Cation trong dung dịch
a. Bảng nhận biết
| Cation | Thuốc thử | Hiện tượng | Giải thích |
| Na+ |
Thử màu ngọn lửa |
Ngọn lửa có màu vàng tươi |
Ion Na+ hầu như không kết tủa với các anion khác |
| NH4+ |
Dung dịch kiềm |
Tạo khí NH3 có mùi khai |
\({\rm{NH}}_{\rm{4}}^{\rm{ + }}{\rm{ + O}}{{\rm{H}}^{\rm{ – }}} \to {\rm{N}}{{\rm{H}}_{\rm{3}}} \uparrow {\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\) |
| Ba2+ |
Dung dịch H2SO4 dư |
Kết tủa màu trắng | \({\rm{B}}{{\rm{a}}^{{\rm{2 + }}}}{\rm{ + SO}}_{\rm{4}}^{{\rm{2 – }}} \to {\rm{BaS}}{{\rm{O}}_{\rm{4}}} \downarrow\) |
| Al3+ |
Dd kiềm hoặc NH3 |
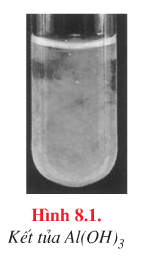
Kết tủa keo trắng tan trong OH– dư |
\({\rm{A}}{{\rm{l}}^{{\rm{3 + }}}}{\rm{ + 3O}}{{\rm{H}}^{\rm{ – }}} \to {\rm{Al(OH}}{{\rm{)}}_{\rm{3}}} \downarrow\) \({\rm{Al(OH}}{{\rm{)}}_{\rm{3}}}{\rm{ + O}}{{\rm{H}}^{\rm{ – }}} \to {\rm{AlO}}_{\rm{2}}^{\rm{ – }}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\) |
| Fe3+ |
Dung dịch kiềm |
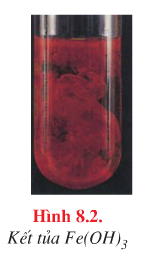
Kết tủa nâu đỏ |
\({\rm{F}}{{\rm{e}}^{{\rm{3 + }}}}{\rm{ + 3O}}{{\rm{H}}^{\rm{ – }}} \to {\rm{Fe(OH}}{{\rm{)}}_{\rm{3}}} \downarrow\) |
| Fe2+ |
Dung dịch kiềm |
Kết tủa trắng xanh→đỏ nâu |
\({\rm{F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{ + 2O}}{{\rm{H}}^{\rm{ – }}} \to {\rm{Fe(OH}}{{\rm{)}}_2} \downarrow\) \({\rm{4Fe(OH}}{{\rm{)}}_{\rm{2}}}{\rm{ + }}{{\rm{O}}_{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{4Fe(OH}}{{\rm{)}}_{\rm{3}}} \downarrow\) |
| Cu2+ |
Dung dịch kiềm |
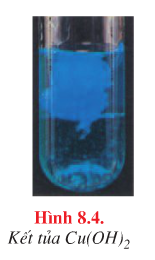
Kết tủa xanh |
\({\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}{\rm{ + 2O}}{{\rm{H}}^{\rm{ – }}} \to {\rm{Cu(OH}}{{\rm{)}}_{\rm{2}}} \downarrow\) |
b. Màu sắc của một số kết tủa

2.3. Nhận biết một số Anion trong dung dịch
a. Bảng nhận biết
| Anion | Thuốc thử | Hiện tượng | Giải thích |
|
NO3– |
Cu / H+ |
Dd có màu xanh, khí thoát ra hóa nâu trong không khí. |
\({\rm{3Cu + 2NO}}_{\rm{3}}^{\rm{ – }}{\rm{ + 8}}{{\rm{H}}^{\rm{ + }}} \to{\rm{3C}}{{\rm{u}}^{{\rm{2 + }}}}{\rm{ + 2NO}} \uparrow {\rm{ + 4}}{{\rm{H}}_{\rm{2}}}{\rm{O}}\) \({\rm{2NO + }}{{\rm{O}}_{\rm{2}}} \to {\rm{2N}}{{\rm{O}}_{\rm{2}}}\) nâu đỏ |
| SO42- |
Dd Ba2+/ H+ dư |
Kết tủa trắng |
\({\rm{B}}{{\rm{a}}^{{\rm{2 + }}}}{\rm{ + SO}}_{\rm{4}}^{{\rm{2 – }}} \to {\rm{BaS}}{{\rm{O}}_{\rm{4}}} \downarrow\) |
| Cl– | Dung dịch AgNO3 |
Kết tủa trắng |
\({\rm{A}}{{\rm{g}}^{\rm{ + }}}{\rm{ + C}}{{\rm{l}}^ – } \to {\rm{AgCl}} \downarrow\) |
| CO32- |
Dd axit mạnh/ Ca(OH)2 |
Kết tủa trắng |
\({\rm{CO}}_{\rm{3}}^{{\rm{2 – }}}{\rm{ + 2}}{{\rm{H}}^{\rm{ + }}} \to {\rm{C}}{{\rm{O}}_{\rm{2}}} \uparrow {\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\) \({\rm{C}}{{\rm{O}}_{\rm{2}}}{\rm{ + Ca(OH}}{{\rm{)}}_{\rm{2}}} \to {\rm{CaC}}{{\rm{O}}_{\rm{3}}} \downarrow {\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\) |