2.1. Vị trí trong Bảng tuần hoàn, cấu hình electron nguyên tử
– Cấu hình electron: 1s22s22p63s23p63d64s2 hay [Ar]3d64s2
– Ô thứ 26, nhóm VIIIB, chu kì 4
– Sắt dễ nhường 2 electron ở phân lớp 4s trở thành ion Fe2+ và có thể nhường thêm 1 electron ở phân lớp 3d để trở thành ion Fe3+.
2.2. Tính chất vật lí
Quan sát Con cá Sắt giúp ngăn ngừa bệnh thiếu máu

– Sắt là kim loại màu trắng hơi xám
– Có khối lượng riêng lớn (d = 8,9 g/cm3), nóng chảy ở 15400C.
– Sắt có tính dẫn điện, dẫn nhiệt tốt và có tính nhiễm từ.
2.3. Tính chất hóa học
– Là kim loại có tính khử trung bình.
– Với chất oxi hoá yếu: Fe → Fe2+ + 2e
– Với chất oxi hoá mạnh: Fe → Fe3+ + 3e
a. Tác dụng với Phi kim
Thí nghiệm: Sắt phản ứng với Lưu huỳnh: \(Fe+S\overset{t^{0}}{\rightarrow}FeS\)
Thí nghiệm: Sắt cháy trong Oxi: \(Fe+O_{2}\overset{t^{0}}{\rightarrow}Fe_{3}O_{4}\)
Thí nghiệm: Sắt tác dụng với Clo: \(2Fe+3Cl_{2}\overset{t^{0}}{\rightarrow}2FeCl_{3}\)
b. Tác dụng với axit
– Với dung dịch HCl, H2SO4 loãng: Fe đưa về sắt (II), H+ chuyển thành H2
Thí nghiệm của Sắt trong dung dịch sunfuric loãng: \(Fe + H_{2}SO_{4}\rightarrow FeSO_{4}+H_{2}\uparrow\)
– Với dung dịch HNO3 và H2SO4 đặc, nóng: Fe khử \(N^{+5}\) hoặc \(S^{+6}\) trong HNO3 hoặc H2SO4 đặc, nóng đến số oxi hoá thấp hơn, còn Fe bị oxi hoá thành \(Fe^{3+}\).
Thí nghiệm: Sắt trong dung dịch HNO3 loãng: \(Fe+4HNO_{3}\rightarrow Fe(NO_{3})_{3}+NO\uparrow+2H_{2}O\)
Lưu ý: Fe bị thụ động bởi các axit HNO3 đặc, nguội hoặc H2SO4 đặc, nguội.
c. Tác dụng với dung dịch muối
– Sắt có thể khử được các ion của các kim loại đứng sau nó trong dãy điện hóa.
Thí nghiệm: Sắt phản ứng với dung dịch Đồng(II) sunfat \(Fe+CuSO_{4}\rightarrow FeSO_{4}+Cu\downarrow\)
d. Tác dụng với nước
– Hình vẽ mô phỏng thí nghiệm: Sắt khử hơi nước ở nhiệt độ cao
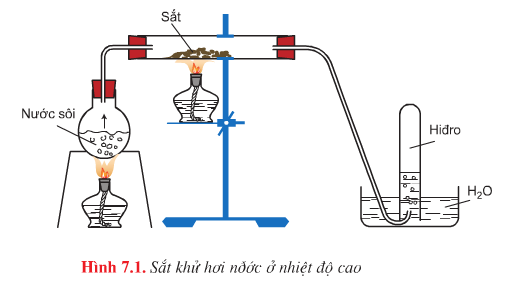
– Phương trình hóa học:
\(3Fe+4H_{2}O\overset{t^{0}<570^{0}C}{\rightarrow}Fe_{3}O_{4}+4H_{2}\uparrow\)
\(Fe+H_{2}O\overset{t^{0}>570^{0}C}{\rightarrow}FeO+H_{2}\uparrow\)
2.4. Ứng dụng
– Chiếm khoảng 5% khối lượng vỏ trái đất, đứng hàng thứ hai trong các kim loại (sau Al).
– Trong tự nhiên sắt chủ yếu tồn tại dưới dạng hợp chất có trong các quặng:
+ Quặng manhetit (Fe3O4)
+ Quặng hematit đỏ (Fe2O3)
+ Quặng hematit nâu (Fe2O3.nH2O)
+ Quặng xiđerit (FeCO3)
+ Quặng pirit (FeS2)
– Có trong hemoglobin (huyết cầu tố) của máu
– Có trong các thiên thạch.