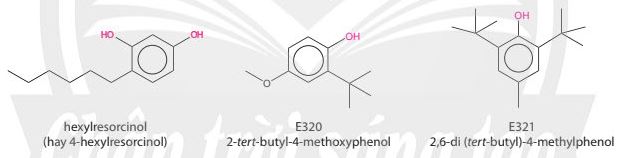
1.1. Khái niệm và cấu trúc
a. Khái niệm
|
Phenol là hợp chất trong phân tử có một hoặc nhiều nhóm hydroxy liên kết trực tiếp với nguyên tử carbon của vòng benzene. |
– Phenol cũng là tên của chất đơn giản nhất (monohydroxybenzene) trong nhóm các hợp chất phenol.
b. Đặc điểm cấu tạo và hình dạng phân tử phenol
– Phenol đơn giản nhất có công thức phân tử C6H6O và công thức cấu tạo C6H5-OH hoặc
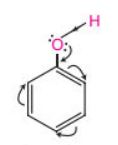
– Phenol có nhóm phenyl hút electron, làm giảm mật độ electron ở nguyên tử oxygen, dẫn đến tăng sự phân cực của liên kết O-H (so với alcohol), đồng thời làm tăng mật độ electron trong vòng benzene, nhiều nhất ở các vị trí ortho và para.

Hình 17.1. Mô hình quả cầu – thanh nối (a) và mô hình đặc (b) của phân tử phenol
1.2. Tính chất vật lí
– Phenol là tinh thể không màu, dễ chảy rữa, chuyển thành màu hồng do hút ẩm và bị oxi hoá chậm trong không khí.
– Phenol tạo được liên kết hydrogen giữa các phân tử và với phân tử nước, dẫn đến nhiệt độ nóng chảy, nhiệt độ sôi của phenol cao hơn và độ hoà tan trong nước tốt hơn một số hydrocarbon thơm khác như benzene, toluene, …
Bảng 17.1.Thông số vật lí của một số hợp chất chứa vòng benzenee
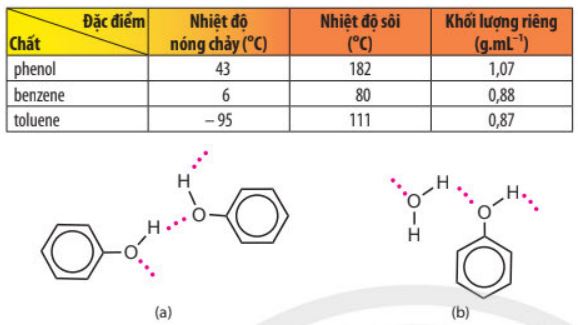
Hình 17.2. Liên kết hydrogen giữa các phân tử phenol (a) và phenol với nước (b)
1.3. Tính chất hoá học
a. Phản ứng thế nguyên tử hydrogen của nhóm OH: Tính acid
|
Trong dung dịch, phenol phân li không hoàn toàn tạo ra ion H+
|
– Phenol thể hiện tính acid yếu.
– Dung dịch phenol không làm đổi màu quỳ tím.
– Tính acid của phenol thể hiện qua phản ứng với dung dịch sodium hydroxide, sodium carbonate,…
Ví dụ:
C6H5OH + NaOH → C6H5ONa + H2O
C6H5OH + Na2CO3 \(\rightleftharpoons\) C6H5ONa + NaHCO3 (1)
(1) Phenol có tính acid mạnh hơn nấc hai của carbonic acid (H2CO3) nên có thể phản ứng được với muối carbonate.
|
Vì phenol gây ngộ độc qua đường miệng, gây bỏng cho da và mắt, nên phải sử dụng găng tay, kính bảo hộ khi tiến hành các thí nghiệm. |
b. Phản ứng thế nguyên tử hydrogen của vòng benzene
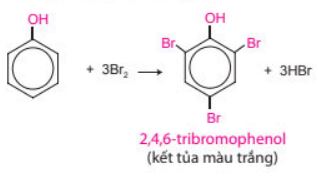
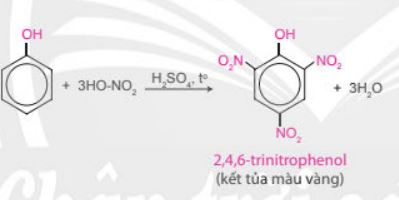
– Khi tham gia phản ứng thế nguyên tử hydrogen của vòng benzene, phân tử phenol ưu tiên thế nguyên tử hydrogen ở các vị trí 2, 4, 6.
Ví dụ:
|
Nhóm OH làm tăng khả năng phản ứng thế nguyên tử hydrogen trong vòng benzene của phenol (dễ thế nguyên tử hydrogen hơn so với benzene). Ưu tiên thế nguyên tử hydrogen ở các vị trí ortho (o-) và para (p-) của phenol. |
|
PICRIC ACID LÀ MỘT CHẤT NỔ Picric acid được sử dụng trong sản xuất chất nổ, diêm, pin điện; dùng để điêu khắc vật liệu bằng đồng, sản xuất thuỷ tinh màu, dùng trong công nghiệp thuộc da và phẩm nhuộm. Picric acid rất dễ bắt nhiệt và có thể phát nổ nếu tiếp xúc với nguồn nhiệt, ngọn lửa, ma sát hoặc va chạm. |
1.4. Ứng dụng và điều chế
a. Ứng dụng

b. Điều chế
|
Phenol được tổng hợp từ cumene (isopropylbenzene) bằng phản ứng oxi hoá bởi oxygen rồi thuỷ phân trong môi trường acid thu được hai sản phẩm là phenol và acetone |
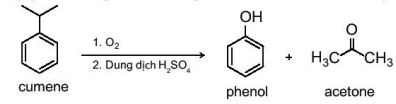
–Hiện nay, phần lớn phenol và acetone đều được sản xuất trong công nghiệp theo phương pháp này.
– Ngoài ra, phenol còn được điều chế từ nhựa than đá.
