1.1. Khái niệm
a. Đặc điểm liên kết và hình dạng phân tử benzene
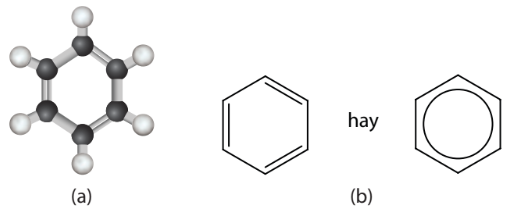
Hình 14.1. Mô hình phân tử benzene (a) và công thức cấu tạo của benzene (b)
– Benzene có công thức phân tử C6H6. Sáu nguyên tử carbon trong phân tử benzene nằm ở sáu đỉnh của một lục giác đều.
– Toàn bộ phân tử nằm trên một mặt phẳng, các góc liên kết đều bằng 120°, độ dài liên kết carbon – carbon đều bằng 139 pm.
b. Viết công thức và gọi tên một số arene
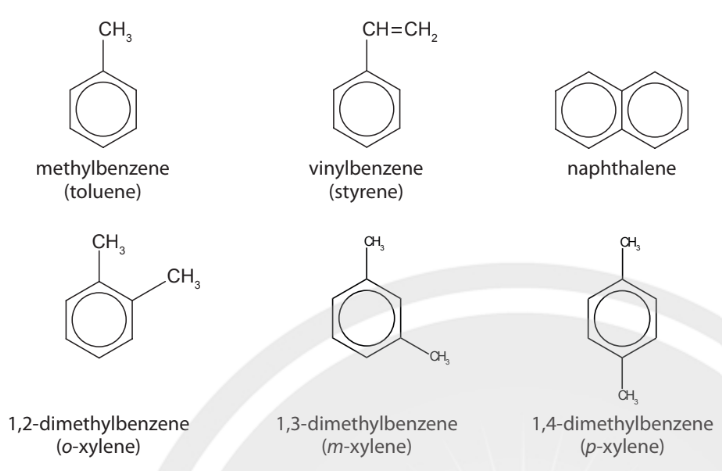
Hình 14.2. Công thức cấu tạo và tên gọi một số hydrocarbon có vòng benzene
– Khi trên vòng benzene có hai nhóm thế, vị trí của chúng có thể được minh hoạ bằng các chữ số 1,2; 1,3 hoặc 1,4 hay bằng các chữ tương ứng là ortho, meta, para (viết tắt là o, m, p).
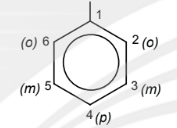
– Tên một số gốc hydrocarbon chứa vòng benzene thường gặp:

|
– Benzene và các alkylbenzene hợp thành dãy đồng đẳng của benzene có công thức chung là CnH2n–6 (n≥6). – Arene là những hydrocarbon có chứa vòng benzene trong phân tử. |
1.2. Tính chất vật lí
a. Tính chất vật lí và trạng thái tự nhiên của một số arene
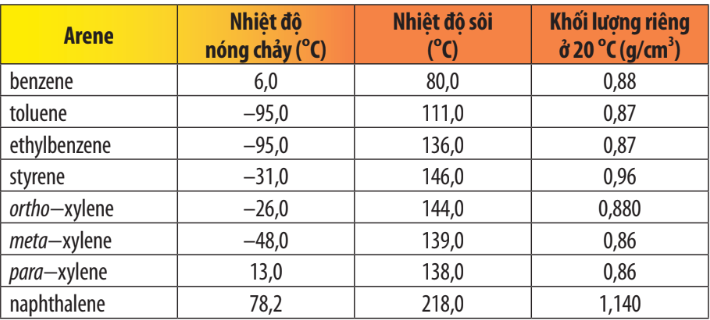
– Trong điều kiện thường, trừ naphthalene ở thể rắn, có màu trắng, các arene còn lại trong Bảng 14.1 đều là những chất lỏng không màu, có mùi đặc trưng.
– Các arene hầu như không tan trong nước nhưng tan nhiều trong dung môi hữu cơ như acetone, diethyl ether, chloroform, …
– Hầu hết arene đều có hại cho sức khoẻ nếu tiếp xúc trong một thời gian dài.
Bảng 14.1. Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng của một số arene
1.3. Tính chất hoá học
a. Phản ứng thế của benzene và toluene
– Khi có mặt xúc tác FeBr3 hoặc AlBr3 benzene tác dụng với bromine khan tạo thành bromobenzene.
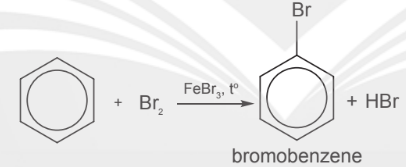
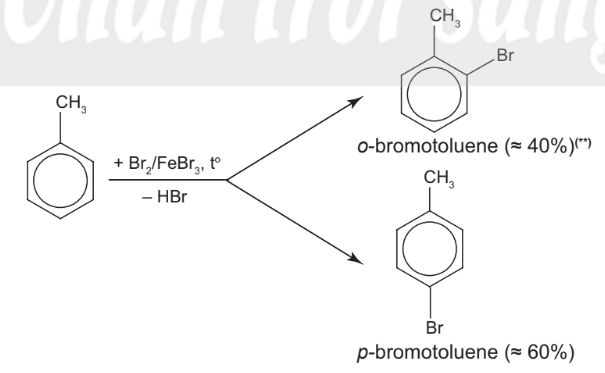
– Toluene phản ứng nhanh hơn benzene trong điều kiện tương tự tạo hỗn hợp sản phẩm chính (đồng phân ortho và para)
b. Phản ứng nitro hoá benzene và toluene
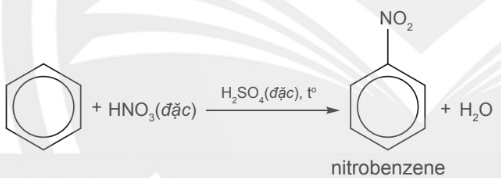
– Benzene tác dụng với hỗn hợp gồm acid HNO3 đặc và H2SO4 đặc ở 60°C tạo chất lỏng màu vàng là nitrobenzene theo phương trình hoá học:
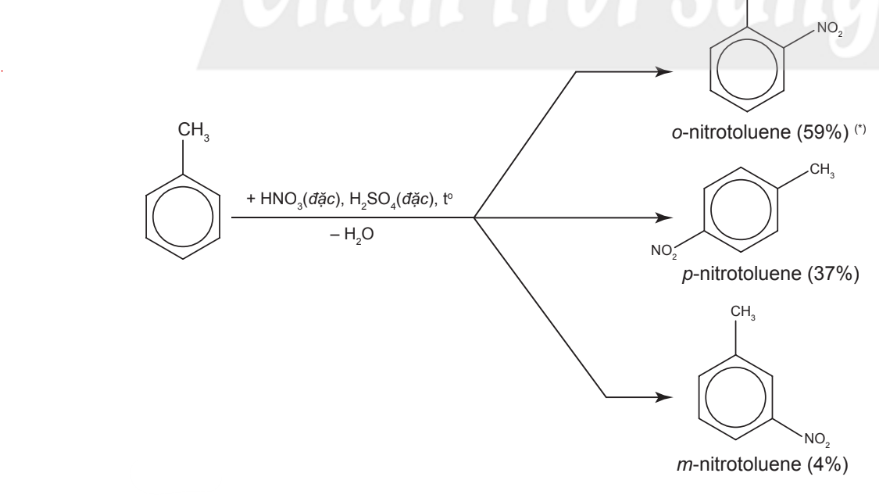
– Phản ứng cũng xảy ra tương tự với toluene, trong đó hướng thế ưu tiên vào các vị trí ortho và para:
c. Phản ứng cộng vào vòng benzene
Phản ứng cộng chlorine vào benzene
Trong điều kiện có chiếu sáng, benzene cộng hợp với chlorine tạo hexachlorocyclohexane (C6H6Cl6) theo phương trình hoá học:

Phản ứng cộng hydrogen vào benzene
– Khi đun nóng và có xúc tác Ni hoặc Pt, benzene cộng hydrogen tạo cyclohexane:

– Phản ứng cộng hydrogen cũng diễn ra trong điều kiện tương tự với các arene khác.
d. Phản ứng oxi hoá
– Các alkylbenzene có thể bị oxi hoá bởi dung dịch KMnO4 khi đun nóng.
C6H5CH3 + 2KMnO4 \(\xrightarrow{{{t}^{o}}}\) C6H5COOK + 2MnO2 + KOH + H2O
– Các arene cháy trong không khí toả nhiều nhiệt:

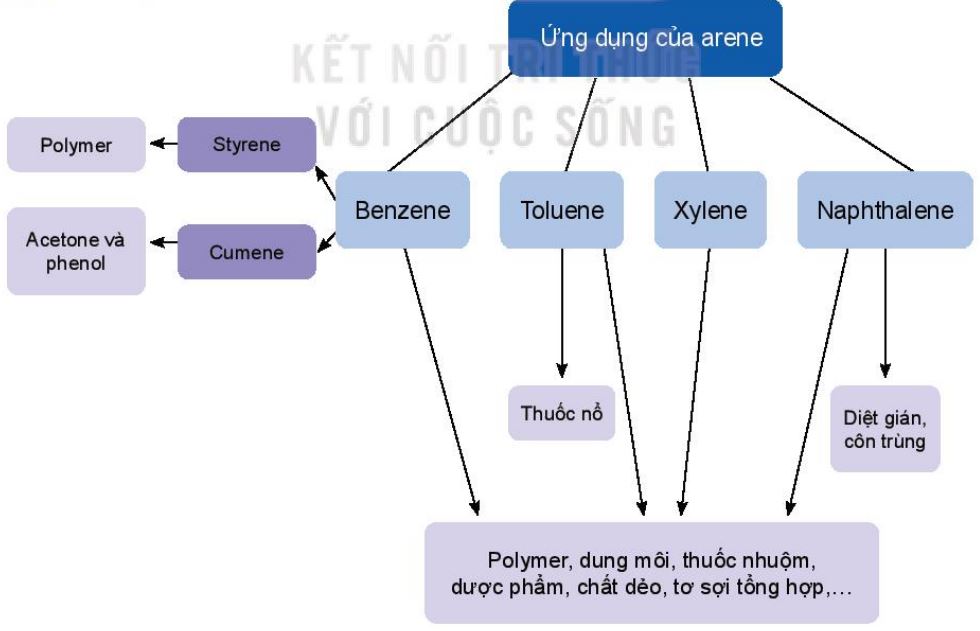
1.4. Ứng dụng và điều chế arene trong công nghiệp
a. Ứng dụng
b. Điều chế arene trong công nghiệp
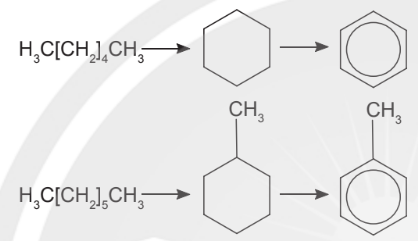
Ngày nay arene hầu hết đều được điều chế từ dầu mỏ qua quá trình reforming xúc tác để chuyển các alkane có chỉ số octane thấp thành các arene có chỉ số octane cao hơn.