1.1. Thuyết cấu tạo hoá học
a. Tìm hiểu thuyết cấu tạo hoá học trong hoá học hữu cơ
– Năm 1861, nhà khoa học A.M. Butlerov (Bút-lê-rốp) đã đưa ra thuyết cấu tạo hoá học. Nội dung cơ bản gồm các luận điểm chính sau:
1. Trong phân tử hợp chất hữu cơ, các nguyên tử liên kết với nhau theo đúng hoá trị và theo một trật tự nhất định. Thứ tự liên kết đó gọi là cấu tạo hoá học. Sự thay đổi thứ tự liên kết, tức là thay đổi cấu tạo hoá học, sẽ tạo ra hợp chất khác.
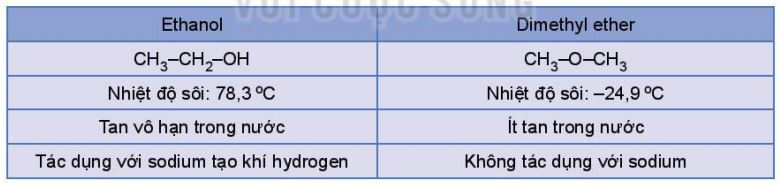
Ví dụ: Ethanol và dimethyl ether đều có công thức phân tử C2H6O nhưng có tính chất vật lí và tính chất hoá học rất khác nhau do chúng có cấu tạo khác nhau.
2. Trong phân tử hợp chất hữu cơ, carbon có hoá trị 4. Nguyên tử carbon không những có thể liên kết với nguyên tử của các nguyên tố khác mà còn liên kết với nhau tạo thành mạch carbon (mạch vòng, mạch hở, mạch nhánh, mạch không nhánh).
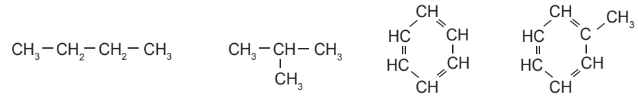
Hình 11.1. Một số chất hữu cơ tương ứng với các dạng mạch carbon khác nhau
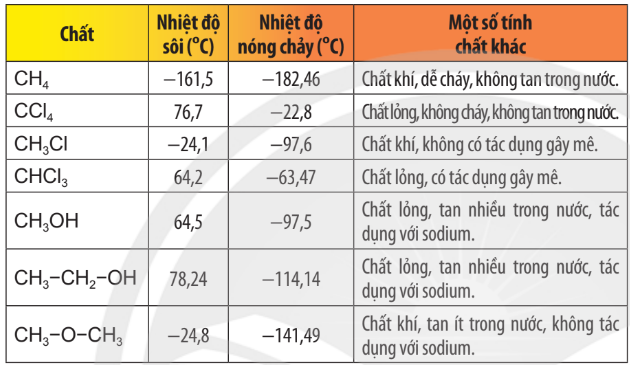
3. Tính chất của các chất phụ thuộc vào thành phần phân tử (bản chất, số lượng các nguyên tử) và cấu tạo hoá học (thứ tự liên kết các nguyên tử).
Bảng 11.1. Tính chất của một số hợp chất hữu cơ
b. Biễu diễn cấu tạo phân tử của hợp chất hữu cơ
– Công thức cấu tạo đầy đủ: biểu diễn đầy đủ tất cả các liên kết trên một mặt phẳng.
– Công thức cấu tạo thu gọn: Các nguyên tử, nhóm nguyên tử cùng liên kết với một nguyên tử carbon được viết thành một nhóm.
– Công thức khung phân tử: Dùng nét gạch để biểu diễn liên kết giữa các nguyên tử carbon với nhau và giữa carbon với nguyên tử khác mà không phải là hydrogen. Trong công thức khung phân tử chỉ ghi kí hiệu các nguyên tử khác C và H (trừ H nằm ở trong nhóm chức).
Ví dụ: Công thức cấu tạo đầy đủ, công thức cấu tạo thu gọn, công thức khung phân tử:


Bảng 11.2. Công thức cấu tạo của một số hợp chất hữu cơ
| Cấu tạo của hợp chất hữu cơ có thể biểu diễn dưới 3 dạng: công thức cấu tạo đầy đủ, công thức cấu tạo thu gọn và công thức khung phân tử. |
1.2. Đồng đẳng, đồng phân
a. Khái niệm chất đồng đẳng và dãy đồng đẳng
| Những hợp chất có thành phần phân tử hơn kém nhau một hay nhiều nhóm CH2 nhưng có tính chất hoá học tương tự nhau là những chất đồng đẳng, chúng hợp thành dãy đồng đẳng với công thức chung xác định. |
Ví dụ:
Một số đồng đẳng alkane (CnH2n+2)

Một số hợp chất hữu cơ trong dãy đồng đẳng alcohol đơn chức, no,mạch hở (CnH2n+1OH).
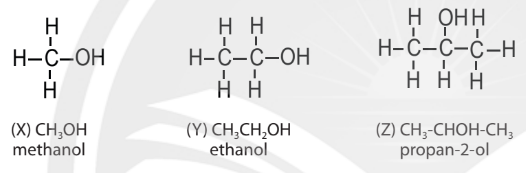
b. Hiện tượng đồng phân trong hoá học hữu cơ
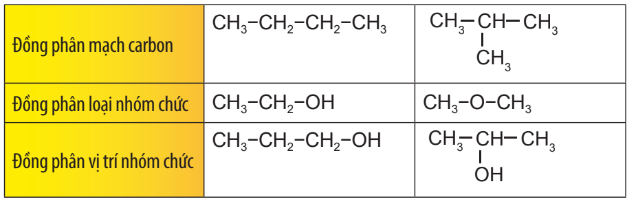
| Những hợp chất khác nhau nhưng có cùng công thức phân tử được gọi là những chất đồng phân. |
Ví dụ:

| Có nhiều loại đồng phân: đồng phân cấu tạo (gồm đồng phân mạch carbon, đồng phân loại nhóm chức, đồng phân vị trí nhóm chức) và đồng phân lập thể (đồng phân khác nhau về vị trí không gian của các nguyên tử, nhóm nguyên tử). |
Ví dụ: