1.1. Phản ứng một chiều, phản ứng thuận nghịch và cân bằng hoá học
a. Tìm hiểu khái niệm phản ứng một chiều
| Trong điều kiện xác định, phản ứng chỉ xảy ra theo chiều từ chất tham gia tạo thành sản phẩm mà sản phẩm không thể tác dụng với nhau để tạo lại chất ban đầu, gọi là phản ứng một chiều. Trong phương trình hoá học của phản ứng một chiều, người ta dùng kí hiệu mũi tên (→) chỉ chiều phản ứng. |
Ví dụ: 2KMnO4 \(\xrightarrow{{{t}^{0}}}\) K2MnO4 + MnO2 + O2
b. Tìm hiểu khái niệm phản ứng thuận nghịch
| Trong cùng điều kiện xác định, phản ứng xảy ra theo hai chiều trái ngược nhau được gọi là phản ứng thuận nghịch. Trong phương trình hoá học của phản ứng thuận nghịch người ta dùng kí hiệu hai nửa mũi tên ngược chiều ( \(\rightleftharpoons \) ): chiều từ trái sang phải là chiều thuận, chiều từ phải sang trái là chiều nghịch. |
Ví dụ: Cl2(g) + H2O(l) \(\rightleftharpoons \) HCl(aq) + HClO(aq)
c. Tìm hiểu khái niệm trạng thái cân bằng của phản ứng thuận nghịch
Cho phản ứng thuận nghịch sau trong điều kiện nhiệt độ, xúc tác và áp suất phù hợp:
N2(g) + 3H2(g) \(\rightleftharpoons \) NH3(g)
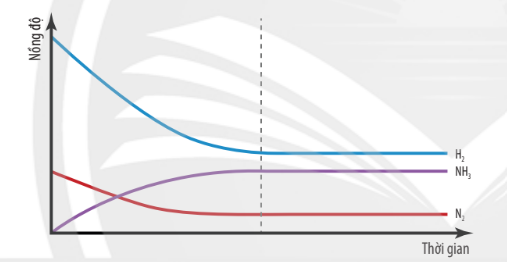
Hình 1.1. Đồ thị biểu diễn nồng độ các chất trong phản ứng theo thời gian
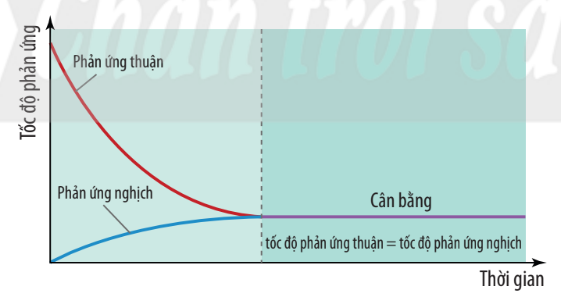
Hình 1.2. Đồ thị biểu diễn tốc độ phản ứng thuận và phản ứng nghịch theo thời gian
| Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái mà tại đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. |
1.2. Hằng số cân bằng của phản ứng thuận nghịch
a. Tìm hiểu hằng số cân bằng của phản ứng thuận nghịch
Xét hệ cân bằng sau: 2NO2(g) \(\rightleftharpoons \) N2O4(g)
(nâu đỏ) (không màu)
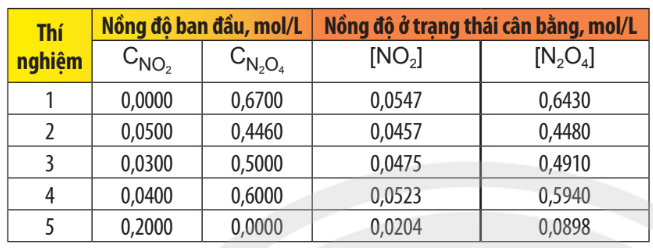
Bảng 1.1. Dữ liệu thực nghiệm về nồng độ các khí trước và sau khi hệ đạt trạng thái cân bằng ở 25°C
Tổng quát, nếu có phản ứng thuận nghịch sau: aA + bB \(\rightleftharpoons\) cC + dD
Khi phản ứng ở trạng thái cân bằng, ta có:
\({{K}_{C}}=\frac{\text{ }{{[\text{ C}]}^{\,c}}\ \text{ }{{[\text{ }\ D\ \text{ }]}^{\,d}}}{\text{ }{{[\text{ }A\text{ }]}^{\,a}}\text{ }{{[\text{ }B\text{ }]}^{\,b}}\text{ }}\)
– Trong đó [A], [B], [C] và [D] là nồng độ mol các chất A, B, C và D ở trạng thái cân bằng; a, b, c và d là hệ số tỉ lượng các chất trong phương trình hoá học.
– Chất rắn không xuất hiện trong biểu thức hằng số cân bằng.
– Trong phản ứng thuận nghịch, hằng số cân bằng Kc của phản ứng xác định chỉ phụ thuộc vào nhiệt độ.
– Trong phản ứng thuận nghịch thì hằng số cân bằng K là một đại lượng có ý nghĩa quan trọng, nó cho biết mức độ xảy ra của một phản ứng.
1.3. Sự chuyển dịch cân bằng hoá học
Thí nghiệm nghiên cứu ảnh hưởng của nhiệt độ tới chuyển dịch cân bằng hoá học
Thí nghiệm 1. Nghiên cứu sự chuyển dịch cân bằng của phản ứng
2NO2(g) \(\rightleftharpoons \) N2O4(g)
(nâu đỏ) (không màu)
Thí nghiệm 2. Nghiên cứu sự chuyển dịch cân bằng của phản ứng thuỷ phân sodium acetate

Hình 1.3. Thí nghiệm nghiên cứu ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng của phản ứng thuỷ phân sodium acetate
| Sự chuyển dịch cân bằng hoá học là sự dịch chuyển từ trạng thái cân bằng này sang trạng thái cân bằng khác. |
1.4. Các yếu tố ảnh hưởng đến cân bằng hoá học
| Những yếu tố làm chuyển dịch cân bằng thường là nồng độ, áp suất và nhiệt độ. Chúng được gọi là các yếu tố ảnh hưởng đến cân bằng hoá học. |
Nguyên lí Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động đó.
a. Tìm hiểu ảnh hưởng của nhiệt độ đến cân bằng hoá học
– Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng thu nhiệt, nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ.
– Ngược lại, khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng toả nhiệt, chiều làm giảm tác động của việc giảm nhiệt độ.
b. Tìm hiểu ảnh hưởng của áp suất đến cân bằng hoá học
– Khi hệ đang ở trạng thái cân bằng, nếu tăng hoặc giảm áp suất của hệ, cân bằng chuyển dịch theo chiều làm giảm hoặc tăng áp suất của hệ.
– Khi hệ cân bằng có tổng hệ số tỉ lượng của các chất khí ở hai vế của phương trình hoá học bằng nhau hoặc trong hệ không có chất khí, việc tăng hoặc giảm áp suất không làm chuyển dịch cân bằng của hệ.
c. Tìm hiểu ảnh hưởng của nồng độ đến cân bằng hoá học
– Nếu trong hệ cân bằng có chất rắn thì việc thêm hoặc bớt lượng chất rắn hầu như không ảnh hưởng đến trạng thái cân bằng của hệ, nghĩa là cân bằng không chuyển dịch.
– Khi tăng hoặc giảm nồng độ một chất trong cân bằng thì cân bằng chuyển dịch theo chiều làm giảm tác động của việc tăng hoặc giảm nồng độ của chất đó, nghĩa là cân bằng sẽ chuyển dịch tương ứng theo chiều làm giảm hoặc tăng nồng độ của chất đó.
| Chất xúc tác không làm thay đổi nồng độ các chất trong hệ cân bằng và cũng không làm thay đổi hằng số cân bằng nên không làm chuyển dịch cân bằng. Chất xúc tác có tác dụng làm tăng tốc độ phản ứng thuận và phản ứng nghịch nên làm cho hệ nhanh chóng đạt trạng thái cân bằng. |