1.1. Sulfuric acid
a. Cấu tạo phân tử và tính chất vật lí
Hình 7.2. Mô hình cấu tạo phân tử H2SO4
– Sulfuric acid là chất lỏng sánh như dầu, không màu, không bay hơi.
– Dung dịch sulfuric acid đặc có khả năng hút ẩm nên thường để dùng làm khô hoá chất trong các bình hút ẩm.
– Sulfuric acid tan tốt trong nước. Quá trình hoà tan toả lượng nhiệt lớn. Vì vậy, để bảo đảm an toàn khi pha loãng dung dịch sulfuric acid đặc, phải cho từ từ acid đặc vào nước, không được cho nước vào acid (Hình 7.3).
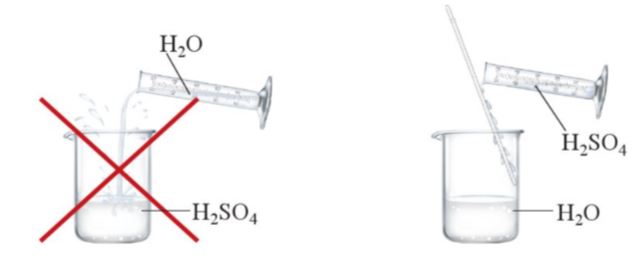
Hình 7.3. Cách pha loãng dung dịch sulfuric acid đặc
b. Tính chất hoá học
Tính chất hoá học của dung dịch sulfuric acid loãng
– Đổi màu quỳ tím thành đỏ.
– Tác dụng với kim loại hoạt động trong dãy hoạt động hoá học.
– Tác dụng với basic oxide và base,
– Tác dụng với nhiều muối.
Tính chất hoá học của dung dịch sulfuric acid đặc
Tính acid
Dung dịch sulfuric acid đặc có tính acid mạnh và khó bay hơi, được sử dụng để điều chế một số acid dễ bay hơi.
Ví dụ: Dung dịch sulfuric acid đặc được dùng trong công nghiệp để điều chế HF bằng cách tác dụng với quặng fluorite.
CaF2 + H2SO4 \(\xrightarrow{{{250}^{o}C}}\) CaSO4 + 2HF
Tính oxi hoá
− Dung dịch sulfuric acid đặc thể hiện tính oxi hoá mạnh, nhất là khi đun nóng, kèm theo sự giảm số oxi hoá của nguyên tử sulfur:
\(\begin{align} & \overset{+6}{\mathop{S}}\,+2e\to \overset{+4}{\mathop{S}}\, \\ & \overset{+6}{\mathop{S}}\,+6e\to \overset{+0}{\mathop{S}}\, \\ & \overset{+6}{\mathop{S}}\,+8e\to \overset{-2}{\mathop{S}}\, \\ \end{align}\)
− Dung dịch sulfuric acid đặc, nóng oxi hoá được nhiều kim loại, phi kim và hợp chất.
Cu + 2H2SO4 \(\xrightarrow{{{t}^{o}}}\) CuSO4 + SO2 + 2H2O
C +2H2SO4 \(\xrightarrow{{{t}^{o}}}\) CO2 + 2SO2 + 2H2O
2KBr + 2H2SO4 \(\xrightarrow{{{t}^{o}}}\) K2SO4 + Br2 + SO2 + 2H2O
Tính háo nước
Dung dịch sulfuric acid đặc có khả năng lấy nước từ hợp chất carbohydrate (Cn(H2O)m) và khiến chúng hoá đen (hiện tượng than hoá).
c. Bảo quản và xử lí bỏng sulfuric acid
Bảo quản
− Sulfuric acid được bảo quản trong chai, lọ có nút đậy chặt đặt ở vị trí chắc chắn.
− Đặt chai, lọ đựng dung dịch sulfuric acid đặc cách xa các dịch sulfuric acid đặc cách xa các lọ chứa chất dễ gây cháy, nổ như chlorate, perchlorate, permanganate, dichromate.

Hình 7.4. Các cảnh báo nguy hiểm được ghi trên nhãn của một chai đựng dung dịch sulfuric acid đặc
Sử dụng
Sulfuric acid gây bỏng khi rơi vào da, do vậy khi sử dụng cần tuân thủ các nguyên tắc:
(1) Sử dụng găng tay, đeo kính bảo hộ, mặc áo thí nghiệm.
(2) Cầm dụng cụ chắc chắn, thao tác cẩn thận.
(3) Không tì, đè chai đựng acid lên miệng cốc, ống đong khi rót acid.
(4) Sử dụng lượng acid vừa phải, lượng acid còn thừa phải thu hồi vào lọ đựng.
(5) Không được đổ nước vào dung dịch acid đặc.
Sơ cứu khi bỏng acid
Khi bị bỏng sulfuric acid cần thực hiện sơ cứu theo các bước sau:
(1) Nhanh chóng rửa ngay với nước lạnh nhiều lần để làm giảm lượng acid bám trên da.
Nếu bị bỏng ở vùng mặt nhưng acid chưa bắn vào mắt thì nhắm chặt mắt khi ngâm rửa. Nếu acid đã bắn vào mắt thì úp mặt vào chậu nước sạch, mở mắt và chớp nhiều lần để rửa acid.
(2) Sau khi ngâm rửa bằng nước, cần tiến hành trung hoà acid bằng dung dịch NaHCO3 loãng (khoảng 2%).
(3) Băng bó tạm thời vết bỏng bằng băng sạch, cho người bị bỏng uống bù nước điện giải rồi đưa đến cơ sở y tế gần nhất.
d. Ứng dụng và sản xuất sulfuric acid
Ứng dụng
− Sản xuất thuốc nhuộm
− Sản xuất chất tẩy rửa
− Chế biến dầu mỏ
− Sản xuất phân bón
− Sản xuất muối, acid
− Sản xuất chất dẻo, tơ sợi
− Sản xuất thuốc nổ
Sản xuất sulfuric acid bằng phương pháp tiếp xúc
Giai đoạn 1. Sản xuất sulfur dioxide
S(s) + O2(g) \(\xrightarrow{{{t}^{o}}}\) SO2(g)
4FeS2(s) + 11O2(g) \(\xrightarrow{{{t}^{o}}}\) 2Fe2O3(s) + 8SO2(g)
Giai đoạn 2. Sản xuất sulfur trioxide
2SO2(g) + O2(g) \(\xrightarrow{{{t}^{o}}}\) 2SO3(g)
Giai đoạn 3. Hấp thụ sulfur trioxide bằng sulfuric acid đặc, tạo ra oleum (hỗn hợp các acid có công thức chung dạng H2SO4.nSO3). Sau đó, pha loãng oleum vào nước thu được dung dịch sulfuric acid loãng.
1.2. Muối sulfate
a. Một số muối sulfate
|
Muối sulfate là hợp chất có chứa ion sulfate (SO42-). |
– Đa số các muối sulfate tan trong nước, calcium sulfate rất ít tan, barium sulfate được coi là không tan trong nước.
– Sau đây là một số muốn sulfate phổ biến cùng với các ứng dụng của chúng trong cuộc sống.
– Ammonium sulfate ((NH4)2SO4) ở dạng tinh thể màu trắng, chủ yếu được dùng làm phân bón cung cấp đạm cho đất.
– Magnesium sulfate (MgSO4) ở dạng tinh thể màu trắng chủ yếu được sử dụng làm phân bón. Muối này còn được sử dụng làm thuốc để cung cấp magnesium cho cơ thể, giúp giảm các cơn đau cơ, giảm hiện tượng chuột rút. Mỗi phân tử magnesium sulfate có thể kết hợp với 7 phân tử nước để tạo MgSO4.7H2O. Vì vậy, magnesium sulfate còn được sử dụng làm chất hút ẩm, chất hút mồ hôi tay của các vận động viên thể dục dụng cụ (Hình 7.5),…

Hình 7.5. MgSO4 được dùng làm chất hút mồ hôi tay của các vận động viên
– Calcium sulfate dihydrate (CaSO4.2H2O) là thành phần chính của khoáng vật gọi là thạch cao tự nhiên (gypsum).
+ Khi nung thạch cao CaSO4.2H2O đến khoảng 150 °C – 180 °C tạo thành thạch cao nung CaSO4.0,5H2O theo phản ứng:
CaSO4.2H2O(s) → CaSO4.0,5H2O(s) + 1,5H2O(g)
– Thạch cao nung có khả năng hút nước và nhanh chóng chuyển lại thành thạch cao. Vì vậy, khi nhào trộn thạch cao nung với nước, nó có khả năng đông cứng rất nhanh. Nhờ tính chất này, thạch cao nung được sử dụng làm vật liệu xây dựng, nặn đúc tượng và khuôn đúc, bỏ chỉnh hình trong y học.
– Thạch cao nung còn được dùng làm chất phụ gia trong chế biến thực phẩm với hàm lượng cho phép nhất định.
– Barium sulfate (BaSO4) ở dạng tinh thể màu trắng, được sử dụng rộng rãi trong các lĩnh vực như sơn, mực in, nhựa, lớp phủ, men, thuỷ tinh, khai thác khoáng sản, sản xuất các loại giấy trắng chất lượng cao.
– Trong y tế, barium sulfate là thành phần chính của thuốc cản quang trong kĩ thuật X-quang.

Hình 7.6. Sản phẩm trang trí được làm từ thạch cao nung
b. Nhận biết ion SO42- trong dung dịch
-Để nhận biết sự có mặt của ion sulfate (SO42-) trong dung dịch, người ta thường sử dụng dung dịch muối của Ba2+ như barium chloride, barium nitrate.
– Phản ứng giữa các muối này với ion SO42- sẽ làm xuất hiện kết tủa màu trắng barium sulfate, theo phương trình ion rút gọn:
Ba2+(aq) + SO42-(aq) → BaSO4(s)
– Kết tủa này không tan trong các dung dịch acid và dung dịch base.
