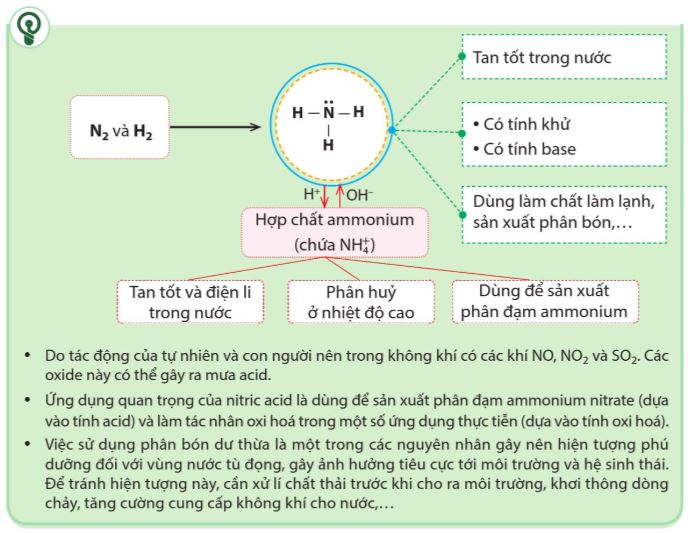
1.1. Ammonia
a. Cấu tạo phân tử và tính chất vật lí
|
Công thức Lewis và dạng hình học (hình chóp tam giác) của phân tử NH3 được thể hiện ở Hình 5.1. |

Hình 5.1. Công thức Lewis (a) và dạng hình học (b) của NH3
– Các liên kết N-H là liên kết cộng hoá trị phân cực nên các phân tử ammonia dễ tạo liên kết hydrogen với nhau và với phân tử nước.
|
Vì tạo được liên kết hydrogen với nước nên ammonia tan nhiều trong nước. |
– Ở điều kiện thường, ammonia là chất khi không màu, có mùi khai, xốc và độc.
b. Tính chất hoá học
Tính base
|
Cặp electron hoá trị riêng trên nguyên tử nirogen là nguyên nhân gây nên tính chất base của ammonia. |
– Khi tan trong nước, ammonia nhận H+ của nước, tạo thành ion ammonium (NH4+), dung dịch có tính base yếu, làm giấy quỳ tím hóa xanh.
NH3(aq) + H2O(l) \(\rightleftharpoons\) NH4+(aq) + OH–(aq)
– Khí ammonia hoặc dung dịch ammonia phản ứng với các acid tạo muối ammonium. Ví dụ:
NH3(aq) + HCl(aq) — NH4Cl(aq)
– Sự hình thành ion ammonium ở các phản ứng trên là do sự tạo thành liên kết cho – nhận giữa nguyên từ nitrogen của phân tử ammonia với H+ (proton) của acid.
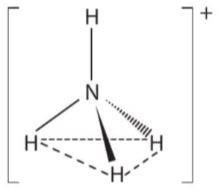
Hình 5.2. Dạng hình học của ion ammonium
|
Vì vậy, ammonia là một base theo thuyết Bronsted—Lowry. |
– Dung dịch ammonia có thể tác dụng với dung dịch muối của một số kim loại để tạo các hydroxide của kim loại.
Ví dụ: MgCl2(aq)+2NH3(aq) + 2H2O(l) → Mg(OH)2(s)+2NH4Cl(aq)
Tính khử
|
Nguyên tử N trong phân tử NH3 có số oxi hoá –3, là số oxi hoá thấp nhất của nguyên tố nitrogen trong các hợp chất. Vì vậy, ammonia thể hiện tính khử khi phản ứng với một số chất có tính oxi hoá. |
Ví dụ:
\( \begin{align} & 4N{{H}_{3}}(g)+3{{O}_{2}}(g)\xrightarrow{{{t}^{0}}}2{{N}_{2}}(g)+6{{H}_{2}}O(g) \\ & 4N{{H}_{3}}(g)+5{{O}_{2}}(g)\xrightarrow{800-{{900}^{0}}C}4NO(g)+6{{H}_{2}}O(g) \\ \end{align}\)
– Phản ứng thứ hai ở trên được sử dụng trong quy trình sản xuất nitric acid từ ammonia trong công nghiệp.
c. Tổng hợp ammonia theo quá trình Haber
Trong công nghiệp, ammonia được tổng hợp theo quá trình Haber (còn được gọi là quá trình Haber – Bosch) như mô tả ở Hình 5.3, theo phương trình hoá học sau:
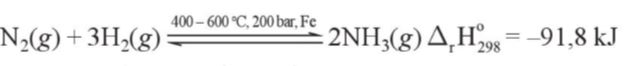
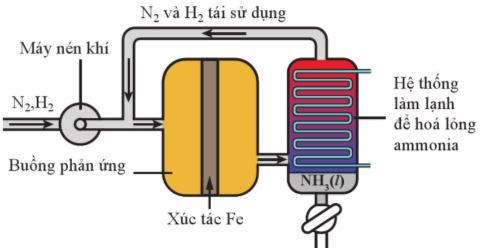
Hình 5.3. Sơ đồ nguyên tắc quá trình Haber tổng hợp ammonia
– Để cân bằng chuyển dịch theo chiều thuận, tạo thành ammonia, cần chọn các điều kiện thích hợp về áp suất, nhiệt độ, dựa theo nguyên lí chuyển dịch Le Chatelier.
+ Về áp suất: người ta đã tăng áp suất của hệ phản ứng trong buồng tổng hợp lên đến gần 200 bar.
+ Về nhiệt độ: Thực tế, người ta đã chọn nhiệt độ phù hợp, khoảng 400 °C – 600 °C.
– Việc sử dụng xúc tác là bột sắt trong quá trình Haber có tác dụng làm cho phản ứng nhanh đạt đến trạng thái cân bằng.
1.2. Muối ammonium
– Muối ammonium là các hợp chất có chứa ion ammonium (NH4+) và gốc acid. Các muối ammonium thường được sử dụng là: NH4CI, NH4NO3, (NH4)2CO3, (NH4)2SO4,…
– Hầu hết các muối ammonium tan tốt và điện li hoàn toàn trong nước.
Ví dụ: NH4CI(s) → NH4+ (aq)+ Cl–(aq)
– Khi đun nóng hỗn hợp muối ammonium và kiềm ở dạng rắn hoặc dung dịch đều sinh ra khi ammonia có mùi khai và xốc.
Ví dụ: 2NH4Cl(s) + Ca(OH)2(s) → 2NH3(g)+2H2O(g) + CaCl2(s)
– Nhờ loại phản ứng này, người ta nhận biết được muối ammonium.
– Các muối ammonium kém bền với nhiệt nên dễ bị phân huỷ ở nhiệt độ cao. Các muối ammonium khác nhau phân huỷ tạo ra các sản phẩm chứa nitrogen khác nhau:
Ví dụ:
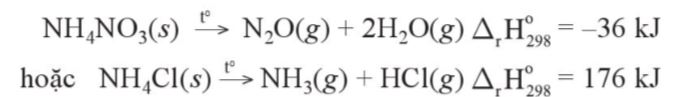
1.3. Ứng dụng của ammonia và một số muối ammonium
|
Ammonia được sử dụng để sản xuất nitric acid, các loại phân đạm. Ammonia còn được sử dụng làm chất làm lạnh, làm dung môi và nhiều ứng dụng quan trọng khác trong đời sống và sản xuất. |

Hình 5.4. Một số ứng dụng của ammonia
|
Muối ammonium được sử dụng rộng rãi trong đời sống và sản xuất, đặc biệt được dùng làm phân bón trong nông nghiệp. |

Hình 5.5. Một số loại phân bón ammonium
1.4. Nguồn gốc một số oxide của nitrogen trong không khí – mưa acid
a. Nguồn gốc một số oxide cúa nitrogen
− Bên cạnh nguồn gốc tự nhiên như:
+ Núi lửa phun trào
+ Cháy rừng
+ Mưa dông kèm theo sấm sét
+ Sự phân huỷ các hợp chất hữu cơ thì sự phát sinh NOx chủ yếu là do hoạt động của con người.
− Các nguồn gây phát thải NOx nhân tạo từ hoạt động giao thông vận tải, sản xuất công nghiệp, nông nghiệp, nhà máy nhiệt điện và trong đời sống.
+ Quá trình sản xuất và sử dụng nitric acid cũng thải các oxide của nitrogen vào khí quyển.
– NOx là một trong các nguyên nhân gây mưa acid, sương mù quang hoá, hiệu ứng nhà kính, thủng tầng ozone và hiện tượng phú dưỡng, làm ô nhiễm môi trường.
b. Mưa acid
– Từ giữa thế kỉ XIX, người ta đã biết nitrogen monoxide, nitrogen dioxide cùng với sulfur dioxide trong khí quyển là nguyên nhân chính dẫn tới sự có mặt của nitric acid và sulfuric acid hoà tan trong nước mưa.
1.5. Nitric acid
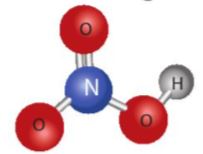
Hình 5.6. Mô hình cấu tạo của phân tử nitric acid
– Công thức Lewis là của nitric acid:
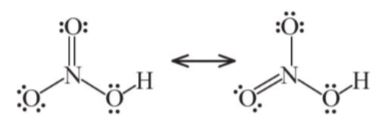
− Đặc điểm cấu tạo của phân tử nitric acid:
+ Nguyên tử N có số oxi hoá +5, là số oxi hoá cao nhất của nitrogen.
+ Liên kết O-H phân cực mạnh về phía nguyên tử oxygen.
+ Liên kết N → O là liên kết cho nhận.
– Nitric acid là chất lỏng không màu, có tính acid mạnh và tính oxi hoá mạnh.
1.6. Hiện tượng phú dưỡng
|
Hiện tượng phú dưỡng là sự tích tụ lượng lớn các chất dinh dưỡng, bao gồm cả hợp chất nitrogen và hợp chất phosphorus trong các nguồn nước, do các tác động từ con người. |
– Theo đó, các nguồn nước thải chưa xử lí triệt để, các nguồn phân bón có thành phần chính như: NH4NO3, (NH2)2CO, (NH4)2HPO4, Ca(H2PO4)2,… dư thừa chảy vào vùng nước tù đọng làm tăng hàm lượng các nguyên tố dinh dưỡng trong nước.
– Hệ quả của hiện tượng này là làm cho các sinh vật trong nước như vi khuẩn, rong, rêu, tảo sinh sôi, nảy nở và phát triển rất mạnh.
– Có thể quan sát được hiện tượng phú dưỡng thông qua sự xuất hiện dày đặc của tảo xanh trong nước. Khi đó, lượng oxygen trong nước sẽ nhanh chóng giảm đi. Điều này là do:
+ Sự hoạt động của lượng lớn vi khuẩn đã hấp thụ đáng kể oxygen hoà tan trong nước.
+ Sự phát triển của tảo xanh đã ngăn cản ánh sáng và không khí chứa oxygen khuếch tán vào nước.
+ Quá trình phân huỷ tảo chết bởi vi khuẩn đã tiêu tốn lượng lớn oxygen trong nước.
– Hệ quả của sự giảm oxygen trong nước đã làm thay đổi hệ sinh thái của nước, tích tụ bùn từ xác của tảo, làm suy kiệt nguồn thuỷ sản.
– Để hạn chế hiện tượng phú dưỡng, cần:
+ Tạo điều kiện để nước trong kênh rạch, ao, hồ được lưu thông.
+ Xử lí nước thải trước khi cho chảy vào kênh rạch, ao, hồ.
+ Sử dụng phân bón đúng liều lượng, đúng cách, đúng thời điểm trong năm để hạn chế sự rửa trôi ion NO3–, PO43- từ nguồn phân bón dư thừa vào kênh rạch, ao, hồ.

Hình 5.7. Tác hại của hiện tượng phú dưỡng