1.1. Trạng thái tự nhiên của nguyên tố nitrogen
– Nguyên tố nitrogen có kí hiệu hoá học là N, số hiệu nguyên tử là 7, độ âm điện là 3,04.
– Ở trạng thái tự nhiên, nitrogen tồn tại ở dạng đơn chất và hợp chất.
– Trong khí quyển, nguyên tố nitrogen tồn tại chủ yếu dưới dạng đơn chất N2, nitrogen chiếm khoảng 78% thể tích của không khí.
– Nitrogen trong tự nhiên là hỗn hợp của hai đồng vị: 14N (99,63%) và 15N (0,37%).
– Ở dạng hợp chất, nitrogen có nhiều trong khoáng vật sodium nitrate (NaNO3) với tên gọi là diêm tiêu natri.
– Trong đất và nước, nitrogen tồn tại chủ yếu dưới dạng ion nitrate (NO3–), nitrite (NO2–) và ammonium (NH4+).
– Nitrogen còn có trong thành phần của protein, nucleic acid, … và nhiều hợp chất hữu cơ khác.
1.2. Đơn chất nitrogen
a. Đặc điểm liên kết
|
Phân tử N2 có liên kết ba giữa hai nguyên tử nitrogen, cả hai nguyên tử này đều thoả mãn quy tắc octet với công thức Lewis như sau: :N\(\equiv \)N: |
b. Tính chất cơ bản
Tính kém hoạt động hoá học (tính trơ) ở nhiệt độ thấp
– Liên kết ba giữa hai nguyên tử N trong phân tử nitrogen có năng lượng liên kết rất lớn (946 kJ mol-1) nên rất khó bị phá vỡ.
– Vì vậy, ở nhiệt độ và áp suất thường, nitrogen rất khó tham gia phản ứng.
– Đặc điểm này được gọi là tính kém hoạt động hoá học hay tỉnh trơ của đơn chất nitrogen.
Tính hoạt động hoá học ở nhiệt độ cao
– Phản ứng của nitrogen và hydrogen diễn ra thuận nghịch, được thực hiện ở điều kiện nhiệt độ và áp suất khá cao cùng với chất xúc tác là bột sắt.

– Nitrogen phản ứng với oxygen ở nhiệt độ rất cao, khoảng 3000 °C, tạo ra nitrogen monoxide (NO).
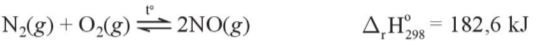
– Trong khi quyển, phản ứng này chính là sự khởi đầu cho quá trình tạo thành ion nitrate (NO3–), được coi là một nguồn cung cấp đạm cho đất.
– Trước tiên, nitrogen monoxide được tạo thành từ nitrogen và oxygen khi có sấm sét.
– Sau đó, nitrogen monoxide nhanh chóng bị oxi hoá bởi oxygen trong khi quyển tạo thành nitrogen dioxide (NO2).
2NO(g) + O2(g) → 2NO2(g) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) = -116,2 kJ
– Tiếp theo là quá trình nitrogen dioxide chuyển thành acid trong nước mưa, có thể được mô tả qua phản ứng:
4NO2(g) + 2H2O(l) + O2(g) → 4HNO3(aq)
– Nước mưa với nồng độ acid phù hợp sẽ giúp cung cấp đạm cho đất ở dạng ion nitrate cần thiết cho cây trồng.
1.3. Ứng dụng
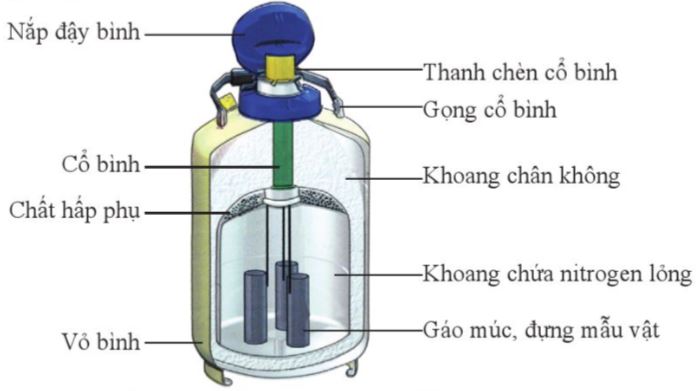
Hình 4.1. Cấu tạo của bình bảo quản mẫu vật bằng nitrogen lỏng


Hình 4.2. Một số ứng dụng của nitrogen
