1.1. Khái niệm phản ứng thuận nghịch và trạng thái cân bằng
– Trong thực tế, nhiều phản ứng không chỉ diễn ra theo một chiều mà đồng thời theo cả hai chiều, chiều thuận và chiều nghịch.
Ví dụ: N2(g) + 3H2(g) \(\rightleftharpoons\) 2NH3(g)
|
Phản ứng thuận nghịch là phản ứng trong đó ở cùng điều kiện xảy ra đồng thời sự chuyển chất phản ứng thành chất sản phẩm và sự chuyển chất sản phẩm thành chất phản ứng. |
– Phản ứng một chiều là phản ứng chỉ xảy ra theo chiều chất phản ứng biến đổi thành chất sản phẩm.
Ví dụ: Fe(s)+ 2HCl(aq) → FeCl2(aq) + H2(g)
– Trong cùng điều kiện, FeCl2 (aq) và H2(g) không thể biến đổi lại thành Fe(s) và HCl(aq) được.
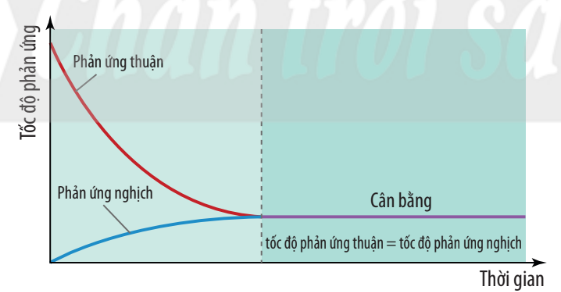
Hình 1.1. Đồ thị biểu diễn tốc độ phản ứng thuận và phản ứng nghịch theo thời gian
|
Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái mà tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. |
– Ở trạng thái cân bằng, phản ứng thuận và phản ứng nghịch vẫn tiếp diễn với tốc độ bằng nhau nhưng nồng độ của một chất bất kì trong phản ứng không đổi là do lượng mất đi và lượng sinh ra chất đó là bằng nhau. Như vậy, cân bằng hoá học là cân bằng động.
1.2. Biểu thức hằng số cân bằng và ý nghĩa
a. Biểu thức hằng số cân bằng
– Với một phản ứng thuận nghịch bất kì, chẳng hạn:
aA + bB \(\rightleftharpoons\) mM + nN
– Khi phản ứng ở trạng thái cân bằng, ta có:
\(\frac{C_{M}^{m}C_{N}^{n}}{C_{A}^{a}C_{B}^{b}}={{K}_{C}}\) (6)
– KC được gọi là hằng số cân bằng (tính theo nồng độ mol); giá trị của KC chỉ phụ thuộc vào bản chất của các chất trong cân bằng và nhiệt độ.
Lưu ý: Nồng độ của các chất trong biểu thức (6) phải là nồng độ mol ở trạng thái cân bằng, chỉ xét những chất ở thể khí hoặc chất tan trong dung dịch. Để nhấn mạnh điều này, người ta hay sử dụng kí hiệu [X] để chỉ nồng độ của chất X ở trạng thái cân bằng. Khi đó, biểu thức (6) được viết lại như sau:
|
Biểu thức hằng số cân bằng KC: \(\frac{\text{ }{{[\text{M}]}^{m}}{{[N\ ]}^{n}}}{\text{ }{{[A]}^{a}}{{[B]}^{b}}\text{ }}={{K}_{C}}\) (7) |
b. Ý nghĩa của biểu thức hằng số cân bằng
– Dựa vào độ lớn của hằng số cân bằng có thể biết được nồng độ của chất tham gia hay chất sản phẩm là chiếm ưu thế ở trạng thái cân bằng, cũng như phản ứng thuận có xảy ra thuận lợi hay không.
– Một cách gần đúng:
+ Nếu phản ứng thuận nghịch có KC rất lớn so với 1 thì phản ứng thuận diễn ra thuận lợi hơn rất nhiều so với phản ứng nghịch; các chất ở trạng thái cân bằng chủ yếu là chất sản phẩm.
+ Nếu phản ứng thuận nghịch có KC rất nhỏ so với 1 thì phản ứng thuận diễn ra kém thuận lợi hơn rất nhiều so với phản ứng nghịch, các chất ở trạng thái cân bằng chủ yếu là chất ban đầu.
1.3. Ảnh hưởng của nhiệt độ, nồng độ, áp suất đến cân bằng hoá học
a. Ảnh hưởng của nhiệt độ tới cân bằng hoá học
Ví dụ: Cân bằng 2NO2 \(\rightleftharpoons\) N2O4(g)có phản ứng thuận là toả nhiệt (làm tăng nhiệt độ môi trường), phản ứng nghịch là thu nhiệt (làm giảm nhiệt độ môi trường).
+ Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều chống lại sự thay đổi đó, nghĩa là theo chiều làm giảm nhiệt độ, đó là chiều nghịch.
+ Ngược lại, khi giảm nhiệt độ, cân bằng sẽ dịch chuyển theo chiều làm tăng nhiệt độ, đó chính là chiều thuận.
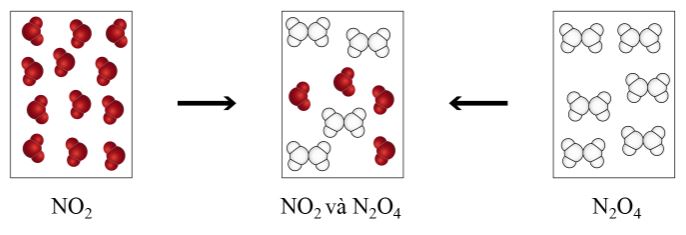
Hình 1.2. Sự biến đổi NO2 VÀ N2O4
– Khi một phản ứng thuận nghịch ở trạng thái cân bằng, nếu thay đổi nhiệt độ thì cân bằng cũ sẽ bị phá vỡ, cân bằng mới được hình thành theo chiều làm giảm sự thay đổi nhiệt độ đó. Ta gọi đây là sự chuyển dịch cân bằng (tử cân bằng cũ sang cân bằng mới).
|
Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều chống lại sự thay đổi đó, nghĩa là theo chiều làm giảm nhiệt độ. Ngược lại, khi giảm nhiệt độ, cân bằng sẽ dịch chuyển theo chiều làm tăng nhiệt độ. |
b. Nguyên lí chuyển dịch cân bằng Le Chatelier
|
Nguyên lí chuyển dịch cân bằng Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến đổi nhiệt độ, nồng độ hay áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó. |
– Chất xúc tác làm tăng đồng thời tốc độ phản ứng thuận và phản ứng nghịch như nhau, do đó không làm chuyển dịch cân bằng hoá học.