1.1. Định luật tuần hoàn
– Nội dung của định luật tuần hoàn: “Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử”.
– Dựa trên xu hướng biển đổi tính chất của các nguyên tố hoá học khi sắp xếp theo chiều tăng dần khối lượng nguyên tử, D. I. Mendeleev đã đưa ra hai quyết định quan trọng:
+ Thứ nhất, ông đã dành chỗ trống cho các nguyên tô khi đó chưa được tìm ra và dự đoán tính chất của chúng (Ví dụ: nguyên tổ gallium và germanium).
+ Thứ hai, ông bỏ qua trật tự cứng nhắc theo chiều tăng của khối lượng nguyên tử để sắp xếp các nguyên tố theo xu hướng biến đổi tính chất (Ví dụ: nguyên tố tellirium có số khối lớn hơn được xếp trước nguyên tố iodine trong bảng tuần hoàn các nguyên tố). Các quyết định này của ông phù hợp với nguyên tắc sắp xếp các nguyên tố theo chiều tăng của điện tích hạt nhân.
| Định luật tuần hoàn: Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử |
|---|
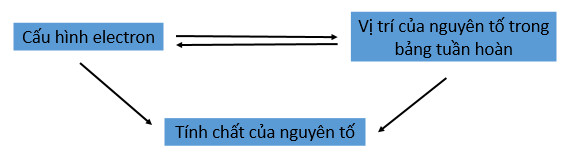
1.2. Ý nghĩa của bảng tuần hoàn
– Vị trí của nguyên tố trong bảng tuần hoàn các nguyên tố hoá học cho biết cấu hình electron nguyên tử, cấu hình electron nguyên tử quyết định tính chất của các nguyên tô. Vì vậy, có thể dự đoán được tính chất hoá học của các nguyên tố khi biết vị trí của nó trong bảng tuần hoàn. các nguyên tố hoá học hay cấu hình electron của nó.
Ví dụ 1: Nguyên tố sulfur (S) ở ô số 16, nhóm VIA, chu ki 3
– Nguyên tử S có:
+ 16 proton, 16 electron (do số proton = Số electron = Z).
+ 3 lớp electron (do số lớp electron bằng số thứ tự chu kì).
+ 6 electron lớp ngoài cùng (do số electron lớp ngoài cùng bằng số thứ tự nhóm A).
– Cấu hình electron của S: 1s22s22p63s23p4. S là nguyên tố phi kim, Oxide cao nhất (SO3) là acidic oxide và acid tương ứng H2SO4 là acid mạnh.
Ví dụ 2: Cấu hình electron của nguyên tử phosphorus (P) là 1s22s22p63s23p3.
– Nguyên từ P có Z = 15 (do số proton = số electron = 2).
– Nguyên tử P ở chu kì 3, nhóm VA (do có 3 lớp electron và có 5 electron ở lớp ngoài cùng).
– P là nguyên tố phi kim. Oxide cao nhất (P2O5) là acidic oxide và acid tương ứng là (HPO4 hay H3PO4) là acid trung bình.
Dựa vào định luật tuần hoàn, có thể so sánh tính chất của một nguyên tố với các nguyên tố xung quanh.
Ví dụ 3: So sánh tính phi kim của P (Z = 15) với N (Z = 7) và S(Z = 16).
Nguyên tố P và N cùng nhóm nên N có tính phi kim mạnh hơn P, P và S cùng chu kì nên P có tính phi kim yếu hơn S.
| Ý nghĩa của bảng tuần hoàn là: Biết vị trí suy ra cấu tạo nguyên từ và tính chất của nguyên tố. Biết cấu tạo nguyên tử suy ra vị trí và tính chất của nguyên tố. |
|---|