1.1. Phản ứng tỏa nhiệt
* Tìm hiểu phản ứng toả nhiệt
– Trong ngành đường sắt, phương pháp hàn nhiệt nhôm được dùng để hàn đường ray. Hỗn hợp tron(III) oxide và bột nhôm được đốt cháy. Phản ứng nhiệt nhôm toả nhiệt rất lớn (trên 2500°C), làm nóng chảy hỗn hợp và sắt sinh ra từ phản ứng lấp đầy khe hở (Hình 13.1). Ngoài ứng dụng để hàn đường ray, phản ứng trên còn được sử dụng hàn nối các thanh kim loại đồng và hàn thép không gỉ, gang.

Hình 13.1. Phản ứng nhiệt nhôm để hàn đường ray
– Thí nghiệm 1: Sự thay đổi nhiệt độ khi vôi sống phản ứng với nước
+ Dụng cụ và thiết bị: Cốc chịu nhiệt 50 ml, cần, nhiệt kế, đũa thuỷ tinh, giá đỡ nhiệt kế.
+ Hoá chất: Vôi sống (CaO), nước cất.
+ Tiến hành:
- Bước 1: Cho khoảng 25 ml nước cất vào cốc chịu nhiệt, đặt bầu nhiệt kế vào trong lòng chất lỏng (Hình 13.2a), ghi nhận giá trị nhiệt độ.
- Bước 2: Cần khoảng 5 g CaO. Cho nhanh Cao vào cốc, bắt đầu bấm giờ và ghi nhận nhiệt độ, đồng thời dùng đũa thuỷ tinh khuấy nhẹ (Hình 13.2b).
- Bước 3: Ghi nhận giá trị nhiệt độ sau khoảng 2 phút.ư
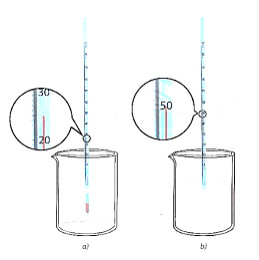
Hình 13.2. Minh họa vôi sống phản ứng với nước
| Phản ứng toả nhiệt là phản ứng hoá học trong đó có sự giải phóng nhiệt năng ra môi trường. |
|---|
1.2. Phản ứng thu nhiệt
* Tìm hiểu phản ứng thu nhiệt

Hình 13.3. Hoà tan viên vitamin C sủi vào cốc nước
– Thí nghiệm 2: Nhiệt phân potassium chlorate
+ Dụng cụ và thiết bị: Đèn cồn, ống nghiệm chịu nhiệt, nút cao su có gắn ống dẫn khí, chậu thuỷ tinh, bình tam giác, giá sắt.
+ Hoá chất: Potassium chlorate (KClO3), manganese dioxide (MnO2).
+ Tiến hành:
- Bước 1: Trộn đều khoảng 4g tinh thể KClO3 đã được nghiền nhỏ với 1g MnO2. Cho hỗn hợp vào ống nghiệm chịu nhiệt, khổ. Đậy ống nghiệm bằng nút có gắn ống dẫn khí. Lắp hệ thống như Hình 13.4. Quan sát hiện tượng.
- Bước 2: Dùng đèn cồn hơ nóng đều nửa đáy ống nghiệm, sau đó đun tập trung ở phần có chứa hoá chất. Quan sát hiện tượng.
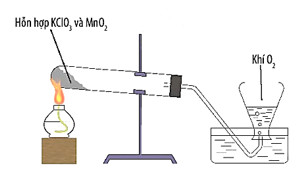
Hình 13.4. Nhiệt phân potassium chlorate
+ Phương trình hóa học của phản ứng: 2KCIO3(s) → 3O2 (g) + 2KCl(s)
| Phản ứng thu nhiệt là phản ứng hoá học trong đó có sự hấp thụ nhiệt năng từ môi trường. |
|---|
1.3. Biến thiên Enthalpy chuẩn của phản ứng
a. Tìm hiểu về biến thiên enthalpy của phản ứng
– Biến thiên enthalpy của phản ứng (hay nhiệt phản ứng) được kí hiệu \({\Delta _r}H\)), thường tính theo đơn vị kJ hoặc kcal.
– Biến thiên enthalpy của phản ứng là lượng nhiệt toả ra hay thu vào của một phản ứng hoá học trong quá trình đẳng áp (áp suất không đổi).
|
– Biến thiên enthalpy chuẩn (hay nhiệt phản ứng chuẩn) của một phản ứng hoá học, được kí hiệu là \({\Delta _r}H_{298}^0\)) là nhiệt kèm theo phản ứng đó trong điều kiện chuẩn. – Điều kiện chuẩn: áp suất 1 bar (đối với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch) và thường chọn nhiệt độ 25°C (hay 298 K). |
|---|
b. Tìm hiểu về phương trình nhiệt hoá học
– Phản ứng thu nhiệt (hệ nhận nhiệt của môi trường) thì \({\Delta _f}H_{298}^0\) > 0.
Ví dụ 1: CH4 (g) + H2O (l) → CO (g) + 3H2 (g)
\({\Delta _r}H_{298}^0\) = 250kJ
– Phản ứng toả nhiệt (hệ toả nhiệt ra môi trường) thì \({\Delta _r}H_{298}^0\) < 0.
Ví dụ 2: C2H5OH(1) + 3O2 (g) → 2CO2 (g) + 3H2O (l)
\({\Delta _r}H_{298}^0\) = -1366,89 kJ
– Các phương trình hoá học của phản ứng trong Ví dụ 1 và 2 được gọi là phương trình nhiệt hoá học.
| Phương trình nhiệt hoá học là phương trình phản ứng hoá học có kèm theo nhiệt phản ứng và trạng thái của các chất đầu (cd) và sản phẩm (sp). |
|---|
1.4. Enthalpy tạo thành (nhiệt tạo thành)
* Tìm hiểu enthalpy tạo thành
+ Enthalpy tạo thành (hay nhiệt tạo thành) được kí hiệu \({\Delta _f}H\), thường tính theo đơn vị kJ/mol hoặc kcal/mol.
| Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất. |
|---|
– Enthalpy tạo thành trong điều kiện chuẩn được gọi là enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) và được kí hiệu là \({\Delta _f}H_{298}^0\)
Ví dụ 3: \({\Delta _f}H_{298}^0\) (CO2, g) = -393,50 kJ/mol là lượng nhiệt toả ra khi tạo ra 1 mol CO2 (g) từ các đơn chất ở trạng thái bền ở điều kiện chuẩn (carbon dạng graphite, oxygen dạng phân tử khí chính là các dạng đơn chất bền nhất của carbon và oxygen).
C(graphite) + O2 → CO2 (g)
\({\Delta _f}H_{298}^0\) (CO2,g) = -393,50 kJ/mol
1.5. Ý nghĩa của dấu và giá trị \({\Delta _r}H_{298}^0\)
* Tìm hiểu về dấu và giá trị biến thiên enthalpy của phản ứng
Ví dụ 4: H2SO4 (aq) + 2NaOH (aq) → Na2SO4 (aq) + 2H2O(1)
\({\Delta _f}H_{298}^0\) = -11,68 kJ
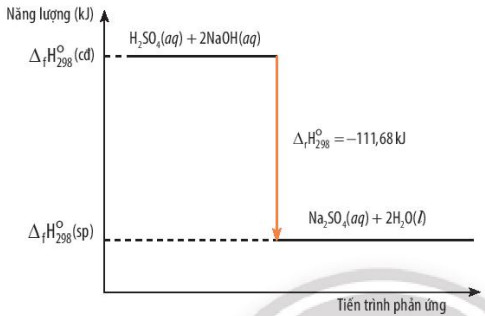
Hình 13.5. Sơ đồ biểu diễn biến thiên enthalpy của phản ứng tỏa nhiệt
Ví dụ 5: Phản ứng nhiệt phân CaCO3
CaCO3 (s) → CaO (s) + CO2(g) \({\Delta _r}H_{298}^0\) = +178,49 kJ
– Khi than (C) hoặc ethanol (C,H,OH) muốn cháy trong không khí cần được đốt nóng, khi cháy phản ứng tỏa nhiệt và tự tiếp diễn mà không cần đốt nóng nữa.
– Nhưng phản ứng nung vôi cần cung cấp nhiệt liên tục, nếu | dừng cung cấp nhiệt phản ứng sẽ không tiếp diễn.
|
– Phản ứng toả nhiệt: \(\sum {\Delta _f}H_{298}^0(sp) < \sum {\Delta _f}H_{298}^0(cd) \to {\Delta _r}H_{298}^0 < 0\) – Phản ứng thu nhiệt: \(\sum {\Delta _f}H_{298}^0(sp) > \sum {\Delta _f}H_{298}^0(cd) \to {\Delta _r}H_{298}^0 > 0\) – Thường các phản ứng có \({\Delta _r}H_{298}^0\) < 0 thì xảy ra thuận lợi. |
|---|