1.1. Số oxi hóa
a. Tìm hiểu về số oxi hoá
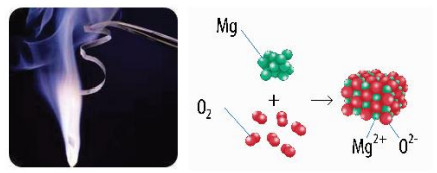
Hình 12.1. Magnesium phản ứng với oxygen

Hình 12.2. Hydrogen phản ứng với chlorine (a) và công thức electron của phân tử hydrogen chloride (b)
– Số oxi hoá là đại lượng quan trọng trong việc nghiên cứu các phản ứng có sự chuyển dịch electron, là điện tích giả định của nguyên tử nguyên tố trong hợp chất.
| Số oxi hoá của một nguyên tử trong phân tử là diện tích của nguyên tử nguyên tố đó nếu giả định cặp electron chung thuộc hẳn về nguyên tử của nguyên tố có độ âm điện lớn hơn. |
|---|
– Cách biểu diễn số oxi hoá:
+ Số oxi hoá được đặt ở phía trên kí hiệu của nguyên tố.
Ví dụ 1:
\(\mathop H\limits^{ + 1} \mathop {Cl}\limits^{ – 1} ,\mathop {Mg}\limits^{ + 2} \mathop O\limits^{ – 2} ,\mathop K\limits^{ + 1} \mathop {Cl}\limits^{ – 1} ,\mathop H\limits^{ + 1} \mathop {Cl}\limits^{ + 1} \mathop O\limits^{ – 2} \)
b. Xác định số oxi hoá của nguyên tử các nguyên tố trong hợp chất
Số oxi hoá của nguyên tử một nguyên tố là một số đại số được gán cho nguyên tử của nguyên tố đó và thường được xác định theo các quy tắc sau:
– Quy tắc 1: Số oxi hoá của nguyên tử trong các đơn chất bằng 0.
Ví dụ 2: Số oxi hoá của các nguyên tử trong đơn chất Na, O2, O3, Hg… đều bằng 0.
– Quy tắc 2: Trong một phân tử, tổng số oxi hoá của các nguyên tử bằng 0.
Ví dụ 3: Tổng số oxi hoá của các nguyên tử trong phân tử NH3 là: (-3) + 3 x (+1) = 0.
– Quy tắc 3: Trong các ion, số oxi hoá của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hoá các nguyên tử (đối với ion đa nguyên tử) bằng điện tích của ion đó.
Ví dụ 4: Số oxi hoá của nguyên tử Na, Cl trong Na+, Cl– lần lượt bằng +1, -1; số oxi hoá của nguyên tử C và O trong \(C{O_3}^{2 – }\;\) lần lượt bằng +4 và -2.
– Quy tắc 4: Trong đa số các hợp chất, số oxi hoá của hydrogen bằng +1, trừ các hydride kim loại (như NaH, CaH2, ..). Số oxi hoá của oxygen bằng -2, trừ OF2 và các peroxide, superoxide (như H2O2, Na2O2, KO2 …). Kim loại kiềm (nhóm IA) luôn có số oxi hoá +1, kim loại kiềm thổ (nhóm IIA) có số oxi hóa +2. Nhôm có số oxi hóa +3. Số oxi hoá của nguyên tử nguyên tố fluorine trong các hợp chất bằng -1.
Ví dụ 5: Tính số oxi hoá của S trong các hợp chất và ion sau: H2S, SO2, SO32-, SO42-
– Đặt x là số oxi hoá của S.
– Trong H2S: 2.(+1) + x = 0 → x= -2 → Kí hiệu \({H_2}\mathop S\limits^{ – 2} \)
– Trong SO2: x + 2.(-2) = 0 → x= +4 → Kí hiệu \(\mathop S\limits^{ + 4} {O_2}\)
– Trong SO32-: x + 3.(-2) = -2 → x = +4 → Kí hiệu \(\mathop S\limits^{ + 4} O_3^{2 – }\)
– Trong \(SO_4^{2 – }\): x + 4.(-2) = -2 → x= +6 → Kí hiệu \(\mathop S\limits^{ + 6} O_4^{2 – }\)
1.2. Phản ứng oxi hóa – khử
a. Tiến hành thí nghiệm nghiên cứu về phản ứng oxi hoá – khử
– Thí nghiệm: Phản ứng oxi hoá kim loại bằng dung dịch acid
– Dụng cụ và hoá chất: Ống nghiệm, dây kẽm (Zn), dung dịch H2SO4 M.
– Tiến hành: Cho vào ống nghiệm 2 – 3 mL dung dịch H2SO4 nhúng tiếp dây kẽm vào.

Hình 12.3. Kim loại Zn phản ứng với dung dịch H2SO4 loãng
– Zn phản ứng với dung dịch H2SO4 theo phương trình hoá học:
\(\mathop {Zn}\limits^0 {\rm{ }} + {\mathop {\;H}\limits^{ + 1} _2}S{O_4}\; \to {\rm{ }}\mathop {Zn}\limits^{ + 2} S{O_4}\; + {\rm{ }}{\mathop H\limits^0 _2}\)
– Zn nhường electron nên Zn là chất khử.
– Quá trình Zn nhường electron gọi là quá trình oxi hoá:
\(\mathop {Zn}\limits^0 \,\,\, \to \,\,\mathop {Zn}\limits^{ + 2} \,\, + \,\,2e\)
– Ion H+ đã nhận electron nên H+ là chất oxi hoá.
– Quá trình H+ nhận electron gọi là quá trình khử:
\(2\mathop {\;H}\limits^{ + 1} \,\, + \,\,\,2e\,\,\, \to \,\,\,{\mathop H\limits^0 _2}\)
Ví dụ 6: Cho kim loại Zn phản ứng với dung dịch CuSO4 (Hình 12.4)

Hình 12.4. Kim loại Zn phản ứng với dung dịch CuSO4
– Zn phản ứng với dung dịch CuSO4 theo phản ứng:
\(\mathop {Zn}\limits^0 {\rm{ }} + \mathop {Cu}\limits^{ + 2} S{O_4}\; \to {\rm{ }}\mathop {Zn}\limits^{ + 2} S{O_4}\; + {\rm{ }}\mathop {Cu}\limits^0 \)
– Quá trình oxi hoá: \(\mathop {Zn}\limits^0 \,\,\, \to \,\,\mathop {Zn}\limits^{ + 2} \,\, + \,\,2e\)
– Quá trình khử: \(\mathop {Cu}\limits^{ + 2} \,\, + \,\,2e \to \mathop {Cu}\limits^0 \,\,\)
| Quá trình oxi hoá (sự oxi hoá) là quá trình nhường electron. Quá trình khử (sự khử) là quá trình nhận electron. |
|---|
b. Tìm hiểu về phản ứng oxi hoá – khử
Ví dụ 7: Khi chlorine tác dụng dung dịch sodium hydroxide theo phương trình hoá học:
\(\mathop {C{l_2}}\limits^0 + \,\,2NaOH \to Na\mathop {Cl}\limits^{ – 1} \,\, + \,\,Na\mathop {Cl}\limits^{ – 1} O\,\, + \,\,{H_2}O\,\,\)
– Trong phản ứng trên, nguyên tử chlorine vừa nhường vừa nhận 1 electron, chỉ có sự thay đổi số oxi hoá của nguyên tử chlorine. Hay có thể nói, chlorine vừa là chất khử, vừa là chất oxi hoá.
|
– Phản ứng oxi hoá – khử là phản ứng hoá học, trong đó có sự chuyển dịch electron giữa các chất phản ứng hay có sự thay đổi số oxi hoá của một số nguyên tử trong phân tử. – Trong phản ứng oxi hoá – khử luôn xảy ra đồng thời quá trình oxi hoá và quá trình khử. |
|---|
– Chất oxi hoá mạnh thường là các hợp chất chứa nguyên tử của nguyên tố có số oxi hoá cao (như \(\mathop {Mn}\limits^{ + 7} O_4^ – ,\mathop {Cr}\limits^{ + 6} {O_3},\mathop {C{r_2}}\limits^{ + 6} O_7^{2 – }\)…) hoặc đơn chất của các nguyên tố có độ âm điện lớn (như F2, O2, Cl2, Br2 ..).
– Chất khử mạnh thường là các hợp chất chứa nguyên tử của nguyên tố có số oxi hoá thấp (như \({H_2}\mathop S\limits^{ – 2} ,K\mathop I\limits^{ – 1} ,Na\mathop H\limits^{ – 1} \) ..) hoặc đơn chất kim loại (như kim loại kiềm, kiếm thô, …).
– Chất chứa nguyên tử của nguyên tố có số oxi hoá trung gian (như \({H_2}\mathop {{O_2}}\limits^{ – 1} ,\mathop S\limits^{ + 4} {O_2},\mathop N\limits^{ + 2} O\)…) thì tuỳ thuộc vào điều kiện phản ứng (tác nhân và môi trường) mà thể hiện tính khử, hoặc tính oxi hoá, hoặc cả hai (vừa tính oxi hoá vừa tính khử hay tự oxi hoá – khử).
1.3. Lập phương trình hóa học của phản ứng oxi hóa – khử
– Có nhiều phương pháp lập phương trình hoá học của phản ứng oxi hoá – khử. Phương pháp thông dụng hiện nay là phương pháp thăng bằng electron.
a. Tìm hiểu cách lập phương trình hoá học của phản ứng oxi hoá – khử bằng phương pháp thăng bằng electron
* Nguyên tắc của phương pháp:
– Tổng số electron chất khử nhường = Tổng số electron chất oxi hoá nhận.
– Để lập phương trình hoá học của phản ứng oxi hoá – khử theo phương pháp thăng bằng electron, ta thực hiện theo các bước như trong ví dụ 8.
Ví dụ 8: Lập phương trình hoá học cho phản ứng sau:
H2S + O2 → SO2 + H2O
+ Bước 1: Xác định số oxi hoá của các nguyên tử có sự thay đổi số oxi hoá trong phản ứng, từ đó xác định chất oxi hoá, chất khử.
\({\mathop H\limits^{ + 1} _2}\mathop S\limits^{ – 2} \,\,\,\, + \,\,\,\,\,\mathop {{O_2}}\limits^0 \,\,\,\,\, \to \,\,\,\,\,\mathop S\limits^{ + 4} {\mathop O\limits^{ – 2} _2}\,\,\,\,\,\, + \,\,\,\,\,{\mathop H\limits^{ + 1} _2}\mathop O\limits^{ – 2} \)
(Chất khử) (Chất oxi hoá).
+ Bước 2: Viết quá trình oxi hoá và quá trình khử.
- Quá trình oxi hoá: \(\mathop S\limits^{ – 2} \,\,\, \to \,\,\,\mathop S\limits^{ + 4} \,\,\, + \,\,\,6e\)
- Quá trình khử: \(\mathop {{O_2}}\limits^0 \,\,\, + \,\,\,4e\,\,\, \to \,\,\,2\mathop O\limits^{ – 2} \)
+ Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khử nhường bằng tổng số electron chất oxi hoá nhận.
\(\begin{array}{l}
2\,\,\,x\,\,\,\,\mathop S\limits^{ – 2} \,\,\, \to \,\,\,\mathop S\limits^{ + 4} \,\,\, + \,\,\,6e\\
3\,\,\,\,x\,\,\,\mathop {{O_2}}\limits^0 \,\,\, + \,\,\,4e\,\,\, \to \,\,\,2\mathop O\limits^{ – 2}
\end{array}\)
+ Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại.
2H2S + 3O2 → 3SO2 + 2H2O
1.4. Ý nghĩa của phản ứng oxi hóa – khử
a. Tìm hiểu về sự cháy của nhiên liệu
– Gas (thành phần chính là hỗn hợp propane (C3H8) và butane (C4H10) được hoả lỏng) được sử dụng làm nhiên liệu trong nấu nướng. Gas cháy trong không khí, xảy ra phản ứng oxi hoá – khử, trong đó các hydrocarbon bị oxi hoá và oxygen bị khử, tạo thành sản phẩm carbon dioxide và nước. Các phản ứng này toả nhiệt lớn và lượng nhiệt này thường được dùng để nấu chín thức ăn (Hình 12.5)

Hình 12.5. Gas cháy trong không khí tỏa nhiệt lớn
– Hỗn hợp khí hydrogen và oxygen là hỗn hợp gây ra phản ứng nổ, trong đó hydrogen là chất khử và oxygen là chất oxi hoá, tạo thành sản phẩm nước, đồng thời giải phóng năng lượng rất lớn. Ngày nay, phản ứng này được áp dụng để kích nổ hỗn hợp nhiên liệu cho các tàu con thoi (Hình 12.6).

Hình 12.6. Tàu con thoi
b. Mô tả một số phản ứng oxi hoá – khử quan trọng gắn liền với cuộc sống
– Quang hợp ở thực vật
+ Quá trình quang hợp xảy ra khi có điều kiện ánh sáng mặt trời, khi đó carbon dioxide và hơi nước được diệp lục hấp thụ, tạo sản phẩm glucose (C6H12O6) để tổng hợp carbohydrate và giải phóng Oxygen.

Hình 12.7. Quá trình quang hợp của cây xanh
– Luyện kim
+ Kĩ thuật điều chế kim loại đòi hỏi áp dụng phản ứng oxi hoá khử như luyện chromium, gang thép, nhôm aluminium), …
+ Sản xuất gang xảy ra qua nhiều giai đoạn, trong đó phản ứng chính là khi có khử iron(III) ở nhiệt độ cao, tạo thành iron nóng chảy và khí carbon dioxide.
– Điện hóa
+ Các quá trình oxi hoá – khử xảy ra có sự tham gia của dòng điện hoặc phát sinh dòng điện như: mạ điện, mạ nhúng nóng; hoạt động pin – ác quy, điện phân;…
+ Pin dùng thông dụng hiện nay là pin kiềm (hay pin alkaline). Thành phần của pin gồm zinc, manganese dioxide và dung dịch potassium hydroxide. Trong môi trường kiềm zin phản ứng với manganese dioxide tạo sản phẩm zinc oxide, manganese(III) oxide và sinh ra dòng điện trong pin.
|
+ Một số phản ứng oxi hoá – khử quan trọng gắn liền với cuộc sống như sự cháy của than, củi; sự cháy của xăng dầu trong các động cơ đốt trong các quá trình điện phân; các phản ứng xảy ra trong pin, ắc quy, … + Một số phản ứng oxi hoá – khử là cơ sở của quá trình sản xuất trong các ngành công nghiệp nặng, sản xuất các hoá chất cơ bản; sản xuất phân bón, thuốc bảo vệ thực vật; dược phẩm; … |
|---|