1.1. Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Ôn tập Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Vị trí trong bảng tuần hoàn
– Nhóm halogen gồm những nguyên tố thuộc nhóm VIIA trong bảng tuần hoàn các nguyên tố hoá học: fluorine (F), chlorine (CI), bromine (Br), iodine (I), astatine (At) và tennessine (Ts).
– Các nguyên tố halogen thuộc nhóm VIIA. Chúng đứng gần cuối chu kì, ngay trước các nguyên tố khí hiếm.
Cấu hình electron, đặc điểm cấu tạo phân tử halogen
– Nguyên tử các nguyên tố halogen đều có 7e lớp ngoài cùng (ns2np5)
– Ở trạng thái tự do, 2 nguyên tử halogen góp chung 1e với nhau tạo 1 liên kết cộng hóa trị không cực.
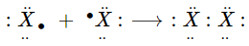
(X là kí hiệu chỉ các nguyên tố halogen)
⟶ Công thức cấu tạo: X−X
⟶ Công thức phân tử: X2
Tính chất vật lý
– Từ fluorine den iodine:
+ Trạng thái tập hợp của đơn chất ở 20°C thay đổi: fluorine và chlorine thể khí, bromine ở thể lỏng, iodine ở thể rắn.
+ Màu sắc đậm dần: fluorine có màu lục nhạt, chlorine có màu vàng lục, bromine có màu nâu đỏ, iodine có màu đen tím.
+ Nhiệt độ nóng chảy và nhiệt độ sôi tăng dần.
– Nhiệt độ nóng chảy và nhiệt độ sôi của đơn chất halogen bị ảnh hưởng bởi tương tác van der Waals giữa các phân tử. Từ fluorine đến iodine, khối lượng phân tử và bán kính nguyên tử tăng, làm tăng tương tác van der Waals, dẫn đến nhiệt độ nóng chảy, nhiệt độ sôi tăng.
Tính chất hóa học
– Tính chất hoá học đặc trưng của halogen là tính oxi hoá mạnh, tính oxi hoá giảm dần từ fluorine den iodine.
+ Tác dụng với kim loại
+ Tác dụng với hydrogen
+ Tác dụng với dung dịch muối halide
+ Tác dụng với dung dịch kiềm
1.2. Hydrogen Halide và một số phản ứng của ion Halide
Ôn tập Hydrogen Halide và một số phản ứng của ion Halide
Tính chất vật lí của Hydrogen Halide
– Nhiệt độ sôi của các hydrogen halide tăng dần từ HCl đến HI. Nguyên nhân là do khối lượng phân tử tăng, làm tăng năng lượng cần thiết cho quá trình sối; đồng thời, sự tăng kích thước và số electron trong phân tử, dẫn đến tương tác van der Waals giữa các phân tử tăng.
– Các phân tử hydrogen fluoride hình thành liên kết hydrogen liên phân tử, loại liên kết này bền hơn tương tác van der Waals, nên nhiệt độ sôi của hydrogen fluoride cao bất thường so với các hydrogen halide còn lại.
Hydrohalic Acid
Tính acid của các hydrohalic acid tăng dần từ hydrofluoric acid đến hydroiodic acid.
Tính khử của các ion Halide
Tính khử của các ion halide tăng theo chiều F– < Cl– < Br– < I–
Nhận biết ion Halide trong dung dịch
Phân biệt các ion F–, Cl–, Br– và I– bằng cách cho dung dịch silver nitrate (AgNO3) vào dung dịch muối của chúng.