1.1. Bán kính nguyên tử
– Giải thích xu hướng biến đối bán kính nguyên tử của các nguyên tố nhóm A.
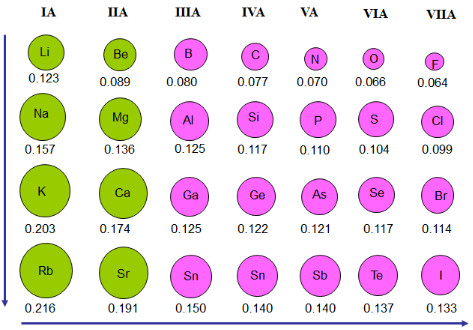
Hình 6.1. Bán kính nguyên tử của một số nguyên tố
– Xu hướng biến đổi bản kinh nguyên tử:
– Bán kính nguyên tử của các nguyên tố nhóm A có xu huong biên đối tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Trong một chu kì, nguyên tử của các nguyên tố có củng so lớp electron. Từ trái sang phải, điện tích hạt nhân nguyên tử tăng dần nên electron lớp ngoài cũng sẽ bị hạt nhân hút mạnh hơn, vì vậy bán kính nguyên tử của các nguyên tố có xu hướng giảm dần
+ Trong một nhóm, theo chiều từ trên xuống dưới, số lớp electron tăng dần nên bán kính nguyên tử có xu hướng tăng.
1.2. Độ âm điện
– Giải thích xu hướng biến đổi độ âm điện của nguyên tử các nguyên tố nhóm A
+ Độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử đó khi tạo thành liên kết hoá học.
+ Trong hoá học, có nhiều thang đo độ âm điện khác nhau do các nhà khoa học tính toán dựa trên những cơ sở khác nhau. Dưới đây giới thiệu bảng giá trị độ âm điện của nhà hoá học L. C. Pauling (Pau-linh) để xuất năm 1932.
Bảng 6.1. Giá trị độ âm điện của nguyên tử một số nguyên tố nhóm A theo Pauling
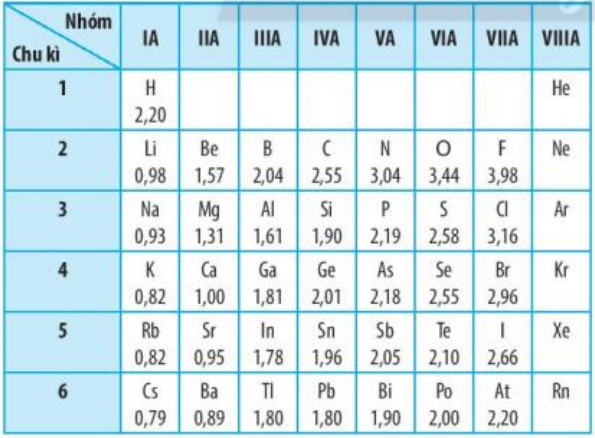
– Xu hướng biến đổi độ âm điện:
– Độ âm điện của nguyên tử các nguyên tố nhóm A có xu hướng biến đối tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng cũng tăng. Do đó, độ âm diện của nguyên từ các nguyên tố có xu hướng tăng dần.
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng nhanh, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm. Do đó, độ âm điện của nguyên tử các nguyên tố có xu hướng giảm dần.
1.3. Tính kim loại, tính phi kim
– Giải thích xu hướng biến đổi tính kim loại, tính phi kim của các nguyên tố nhóm A
– Tính kim loại là tính chất của một nguyên tố mà nguyên tử dễ nhường electron.
– Tính phi kim là tính chất của một nguyên tố mà nguyên tử dễ nhận electron.
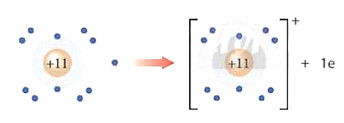
Nguyên tử sodim (Na) Ion sodium (Na+)
a)

Nguyên tử fluorine (F) Ion fluoride (F–)
b)
Hình 6.2. Quá trình nhường, nhận electron của nguyên tử sodium (a) và fluorine (b)
– Xu hướng biến đổi tính kim loại, tỉnh phi kim:
– Tính kim loại, tính phi kim của các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cũng tăng. Do đó, tính kim loại của các nguyên tố giảm dần, tính phi kim tăng dần.
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các clectron lớn ngoài cùng giảm. Do đó, tính kim loại của các nguyên tố tăng dần, tính phi kim giảm dần.
1.4. Tính acid – base của oxide và hydroxide
– Nhận xét xu hướng biến đổi tính acid – base của oxide và hydroxide tương ứng theo chu kì
– Xét một số phản ứng sau:
Na2O + 2HCl → 2NaCl + H2O
NaOH + HCl → NaCl + H2O
Al2O3 + 6HCl → AlCl3 + 3H2O
Al2O3 + 2KOH + 3H2O → 2K[Al(OH)4]
Al(OH)3 + KOH → K[Al(OH)4]
Al(OH)3 + 3HCl → AlCl3 + 3H2O
SO3 + KOH → KHSO4
SO3 + 2KOH → K2SO4 + H2O
H2SO4 + 2KOH → KHSO4 + 2H2O
Bảng 6.2. Tính acid – base của oxide và hydroxide tương ứng của các nguyên tố thuộc chu kì 2 và 3 (ứng với hoá trị cao nhất của các nguyên tố)
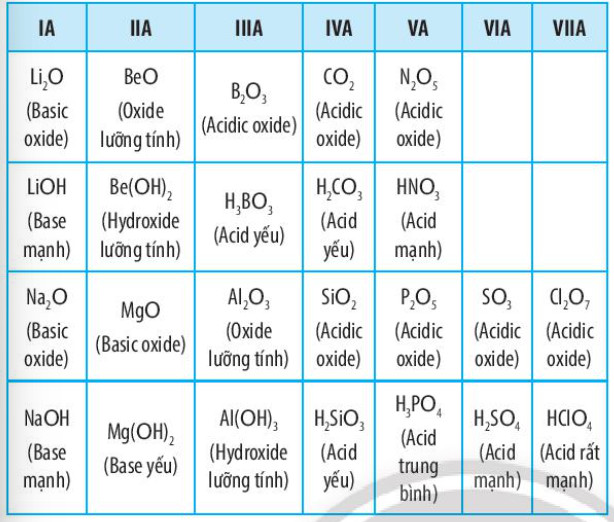
– Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, tính acid của chúng tăng dần.