1.1. Ảnh hưởng của nồng độ
* Nghiên cứu ảnh hưởng của nồng độ đến tốc độ phản ứng
Thí nghiệm 1: Ảnh hưởng của nồng độ đến tốc độ phản ứng
– Hoá chất: dung dịch sodium thiosulfate (Na2S2O3) 0,15 M; sulfuric acid (H2SO4) 0,10 M; nước cất.
– Dụng cụ: cốc thuỷ tinh 100 mL (được đánh dấu thập ở mặt ngoài đáy cốc), ống đong 50 mL.
– Tiến hành:
+ Bước 1: Pha loãng dung dịch Na2S2O3 0,15 M để được các dung dịch có nồng độ khác nhau theo Bảng 16.1.
Bảng 16.1. Cách pha loãng dung dịch Na2S2O3
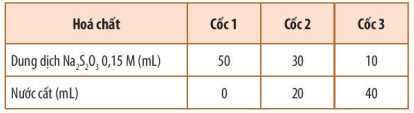
+ Bước 2: Rót đồng thời 10 mL dung dịch H2SO4 0,1 M vào mỗi cốc và khuấy đều.
Phương trình hoá học của phản ứng: Na2S2O3 (aq) + H2SO4 (aq) → Na2SO4 (aq) +S (s) + SO2 (g) + H2O(l)

Hình 16.1. Thí nghiệm ảnh hưởng của nồng độ đến tốc độ phản ứng
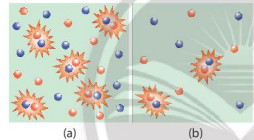
Hình 16.2. Hình minh hoạ chất phản ứng có nồng độ lớn (a) và nồng độ bé (b)
– Nồng độ của các chất phản ứng tăng làm tăng số va chạm hiệu quả nên tốc độ phản ứng tăng.
| Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng. |
|---|
1.2. Ảnh hưởng của nhiệt độ
– Nghiên cứu ảnh hưởng của nhiệt độ đến tốc độ phản ứng
Ví dụ 1: Có 2 cốc thủy tinh, mỗi cốc đựng cùng một lượng hỗn hợp dụng dịch oxalic acid (H2C2O4) và dung dịch H2SO4 loãng, tỉ lệ 2:1 về thể tích, cốc (1) được đun nóng, thêm đồng thời cùng một lượng dung dịch KMnO4 vào mỗi cốc (Hình 16.3a), nhận thấy màu của hỗn hợp phản ứng nhạt dần theo thời gian phản ứng (Hình 16.3b).
– Phương trình hoá học của phản ứng: 2KMnO4 (aq) +5H2C2O4 (aq) + 3H2SO4 (aq) →MnSO4 (aq) + K2SO4 (aq) +10CO2(g) +8H2O (1)

Hình 16.3. Thí nghiệm ảnh hưởng của nhiệt độ đến tốc độ phản ứng
– Ở nhiệt độ thường, các chất phản ứng chuyển động với tốc độ nhỏ; khi tăng nhiệt độ, các chất sẽ chuyển động với tốc độ lớn hơn, dẫn đến tăng số va chạm hiệu quả nến tốc độ phản ứng tăng.
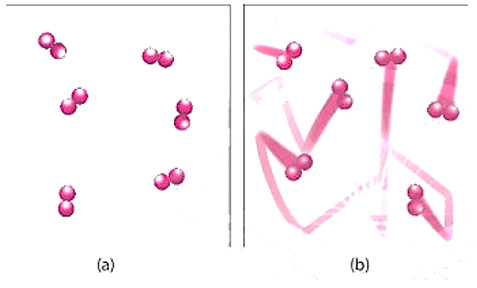
Hình 16.4. Hình minh hoạ chuyển động của chất phản ứng khi chưa đun nóng (a) và được đun nóng (b)
– Kết quả từ các thực nghiệm cho biết, khi nhiệt độ tăng lên 10°C, tốc độ của phần lớn các phản ứng tăng từ 2 đến 4 lần. Số lần tăng này được gọi là hệ số nhiệt độ Van’t Hoff (Van-hop), kí hiệu là \(\gamma \).
– Trong Ví dụ 1, nếu nhiệt độ ban đầu của 2 cốc bằng nhau, t1 = 20°C, nhiệt độ của cốc (1) sau khi đun nóng là t2= 60°C, nhiệt độ cốc (2) không thay đổi và tốc độ phản ứng trong cốc (1) gấp 16 lần cốc (2). Khi đó ta có:
\({\gamma ^{\frac{{60 – 20}}{{10}}}} = 16 \to \gamma = 2\)
– Vậy, khi nhiệt độ tăng lên 10°C, thì tốc độ phản ứng tăng 2 lần. Giá trị này là hệ số nhiệt độ Van’t Hoff.
|
– Khi tăng nhiệt độ, tốc độ phản ứng tăng. – Mối quan hệ giữa nhiệt độ và tốc độ phản ứng hoá học được biểu diễn bằng công thức: \(\frac{{{v_{{t_2}}}}}{{{v_{{t_1}}}}} = {\gamma ^{\frac{{{t_2} – {t_1}}}{{10}}}}\) Trong đó: vt1, vt2 là tốc độ phản ứng ở 2 nhiệt độ t1 và t2; \(\gamma \) là hệ số nhiệt độ Van’t Hoff. Quy tắc Vant Hoff chỉ gần đúng trong khoảng nhiệt độ không cao. |
|---|
1.3. Ảnh hưởng của áp suất
* Nghiên cứu ảnh hưởng của áp suất đến tốc độ phản ứng
– Trong phản ứng hoá học có sự tham gia của chất khí, áp suất có thể ảnh hưởng đến tốc độ phản ứng.
Ví dụ 2: Một trong những nghiên cứu nhằm giảm thiểu phát thải khí CO2 vào khí quyển gây hiệu ứng nhà kính, là chuyển CO2 thành sản phẩm có giá trị như methanol (CH3OH).
Phản ứng cần thực hiện ở áp suất cao, khoảng 58 – 103 bar để tăng tốc độ phản ứng. Phương trình hoá học của phản ứng:
CO2(g) + 3H2(g) → CH3OH(g) + H2O(g)

Hình 16.5. Minh hoạ khi tăng áp suất của các chất khí tham gia phản ứng
– Khi tăng áp suất thì nồng độ chất khí tăng, nên tốc độ phản ứng tăng.
| Đối với phản ứng có chất khí tham gia, tốc độ phản ứng tăng khi tăng áp suất. |
|---|
1.4. Ảnh hưởng của bề mặt tiếp xúc
a. Nghiên cứu ảnh hưởng của bề mặt tiếp xúc đến tốc độ phản ứng
Thí nghiệm 2: Ảnh hưởng của bề mặt tiếp xúc đến tốc độ phản ứng
– Hoá chất: dung dịch HCl 1 M, đá vôi (CaCO3) dạng khối và dạng hạt nhỏ.
– Dụng cụ: bình tam giác 100 mL, ống đong 50 mL, cân.
– Tiến hành:
+ Bước 1: Cần khoảng 2 g CaCO3 mỗi loại, cho vào 2 bình tam giác (1), (2).
+ Bước 2: Đong khoảng 20 ml dung dịch HCl, rót đồng thời vào mỗi bình tam giác.
Phương trình hoá học của phản ứng:
CaCO3(s) + 2HCl(aq) → CaCl2(aq) + H2O(1) + CO2(g)
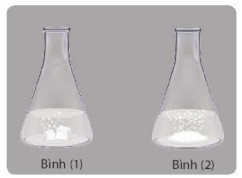
Hình 16.6. Minh hoạ thí nghiệm nghiên cứu ảnh hưởng của bề mặt tiếp xúc đến tốc độ phản ứng
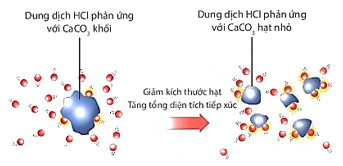
Hình 16.7. Minh hoạ dung dịch HCl phản ứng với CaCO3 có kích thước khác nhau
| Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng. |
|---|
1.5. Ảnh hưởng của chất xúc tác
– Với một số phản ứng hoá học, để tăng tốc độ phản ứng, người ta sử dụng chất xúc tác, được ghi trên mũi tên trong phương trình hoá học.
* Nghiên cứu ảnh hưởng của xúc tác đến tốc độ phản ứng
– Thí nghiệm 3: Ảnh hưởng của xúc tác đến tốc độ phản ứng
– Hoá chất: dung dịch hydrogen peroxide (H2O2) 30%, bột MnO2
– Dụng cụ: ống nghiệm, tàn đóm đỏ.
– Tiến hành:
+ Bước 1: Rót khoảng 2 mL dung dịch H2O2 vào 2 ống nghiệm (1), (2).
+ Bước 2: Thêm một ít bột MnO2 vào ống nghiệm (2) và đưa nhanh tàn đóm đỏ vào miệng 2 ống nghiệm (Hình 16.8).
Phương trình hoá học của phản ứng:
2H2O2 (aq) → 2H2O (l) + O2 (g)

Hình 16.8. Thí nghiệm nghiên cứu ảnh hưởng của xúc tác đến tốc độ phản ứng
| Chất xúc tác làm tăng tốc độ của phản ứng hoá học, nhưng vẫn được bảo toàn về lượng và chất khi kết thúc phản ứng. |
|---|
1.6. Ý nghĩa thực tiễn của tốc độ phản ứng trong đời sống và sản xuất
* Tìm hiểu các yếu tố ảnh hưởng đến tốc độ phản ứng trong đời sống và sản xuất
– Vận dụng các yếu tố ảnh hưởng đến tốc độ phản ứng sẽ góp phần hiệu quả vào phục vụ đời sống, sản xuất, thúc đẩy quá trình diễn ra nhanh hơn hoặc hạn chế tốc độ của phản ứng, nhằm tối ưu hoá giá trị kinh tế.

(a) Dùng bình chứa oxygen thay cho dùng không khí để đốt cháy acetylene, ứng dụng trong đèn xì acetylene.

(b) Thực phẩm nấu trong nổi áp suất sẽ nhanh chín hơn so với khi nấu ở áp suất thường.

(c) Khi đốt than trong lò, đậy nắp lò sẽ giữ than cháy được lâu hơn

(d) Bảo quản thức ăn trong tủ lạnh để thức ăn lâu bị ôi thiu
Hình 16.9. Ý nghĩa thực tiễn của tốc độ phản ứng trong đời sống và sản xuất
| Kiểm soát tốc độ các phản ứng diễn ra trong đời sống, sản xuất khi vận dụng các yếu tố ảnh hưởng như: nồng độ, nhiệt độ, áp suất, bề mặt tiếp xúc và chất xúc tác giúp mang lại các giá trị hiệu quả. |
|---|