1.1. Tốc độ phản ứng
a. Trình bày khái niệm tốc độ phản ứng hoá học
– Khái niệm tốc độ phản ứng hoá học dùng để đánh giá mức độ xảy ra nhanh hay chậm của một phản ứng.
– Theo thời gian, nồng độ các chất phản ứng và sản phẩm thay đổi nên tốc độ phản ứng sẽ thay đổi, vì vậy người ta thường tính tốc độ trung bình của phản ứng. Ngoài ra, còn có tốc độ tức thời của phản ứng, là tốc độ phản ứng tại một thời điểm nào đó.
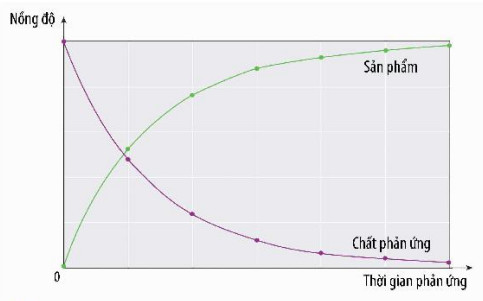
Hình 15.1. Đồ thị biểu diễn sự thay đổi nồng độ chất phản ứng nồng độ của chất phản ứng và (màu tím) và sản phẩm (màu xanh) theo thời gian
b. Tính tốc độ trung bình của phản ứng hoá học
Ví dụ 1: Trong phản ứng hoá học: Mg (s) + 2HCl (aq) → MgCl2 (aq) + H2 (g)
Sau 40 giây, nồng độ của dung dịch HCl giảm từ 0,8 M về còn 0,6 M. Tính tốc độ trung bình của phản ứng theo nồng độ HCl trong 40 giây.
Hướng dẫn:
Thời gian phản ứng: \(\Delta \)t = 40 (s)
Biến thiên nồng độ dung dịch HCl là \(\Delta \)C = 0,6 – 0,8 = -0,2 (M)
Hệ số cân bằng của HCl trong phương trình hóa học là 2.
|
Tốc độ trung bình của phản ứng trong 40 giây là: \(\overline v = – \frac{1}{2}.\frac{{ – 0,2}}{{40}} = 2,{5.10^{ – 3}}(M/s)\) – Tốc độ phản ứng của phản ứng hoá học là đại lượng đặc trưng cho sự biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian. Tốc độ phản ứng kí hiệu là v, có đơn vị: (đơn vị nồng độ)/ (đơn vị thời gian) – Tốc độ trung bình của phản ứng là tốc độ được tính trong một khoảng thời gian phản ứng. – Cho phản ứng tổng quát: aA + bB → bC + dD Biểu thức tốc độ trung bình của phản ứng: \(\overline v = – \frac{1}{a}.\frac{{\Delta {C_A}}}{{\Delta t}} = – \frac{1}{b}.\frac{{\Delta {C_B}}}{{\Delta t}} = \frac{1}{c}.\frac{{\Delta {C_C}}}{{\Delta t}} = \frac{1}{d}.\frac{{\Delta {C_D}}}{{\Delta t}}\) Trong đó: \(\overline v \) : tốc độ trung bình của phản ứng \(\Delta C = {C_2} – {C_1}\): sự biến thiên nồng độ \(\Delta t = {t_2} – {t_1}\): biến thiên thời gian C1, C2 là nồng độ của một chất tại 2 thời điểm tương ứng t1, t2 |
|---|
1.2. Biểu thức tốc độ phản ứng
* Tìm hiểu về định luật tác dụng khối lượng
– Các phản ứng diễn ra với tốc độ khác nhau tùy thuộc vào nhiều yếu tố: nồng độ, nhiệt độ, áp suất đối với chất tham gia là chất khí, bề mặt tiếp xúc, chất xúc tác, cường độ ánh sáng, thể của chất, dung môi hoà tan các chất phản ứng, …
– Năm 1864, hai nhà bác học Guldberg (Gấu-bớc) và Waage (Qua-ge) khi nghiên cứu sự phụ thuộc của tốc độ vào nồng độ đã đưa ra định luật tác dụng khối lượng: Ở nhiệt độ không đổi, tốc độ phản ứng tỉ lệ với tích số nồng độ các chất tham gia phản ứng với số mũ thích hợp.
Ví dụ 2: Xét phản ứng
2CO(g) + O2(g) → 2CO2(g)
Biểu thức tốc độ tức thời của phản ứng viết theo định luật là:
\(v = k.C_{CO}^2.{C_{{O_2}}}\)
|
– Phản ứng đơn giản có dạng: aA+ bB →cC + dD – Mối quan hệ giữa nồng độ và tốc độ tức thời của phản ứng hoá học được biểu diễn bằng biểu thức: \(v = k.C_A^a.C_B^b\) – Trong đó, k là hằng số tốc độ phản ứng; CA, CB là nồng độ (M) chất A, B tại thời điểm đang xét. – Khi nồng độ chất phản ứng bằng đơn vị (1 M) thì k = v, vậy k là tốc độ của phản ứng và được gọi là tốc độ riêng, đây là ý nghĩa của hằng số tốc độ phản ứng. – Hằng số k chỉ phụ thuộc vào bản chất của chất phản ứng và nhiệt độ. |
|---|