1.1. Xác định biến thiên Enthalpy của phản ứng dựa vào năng lượng liên kết
– Tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết
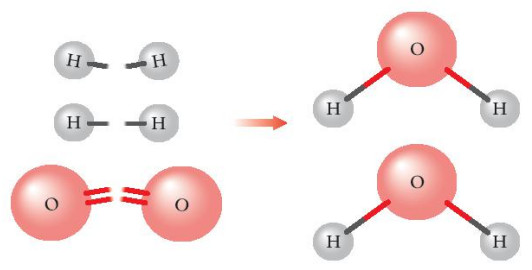
Hình 14.1. Sự hình thành phân tử nước
– Phản ứng hóa học xảy ra khi có sự phá vỡ các liên kết hoá học của chất đầu (cđ) và hình thành các liên kết hoá học của sản phẩm (sp). Sự phá vỡ các liên kết cần cung cấp năng lượng, sự hình thành các liên kết lại giải phóng năng lượng.
– Cho phản ứng tổng quát ở điều kiện chuẩn: aA (g) + bB (g) → mM (g) + nN (g)
– Tính \({\Delta _r}H_{298}^0\) của phản ứng khi biết các giá trị năng lượng liên kết (Eb) theo công thức:
\({\Delta _r}H_{298}^0\) = a x Eb (A) + b x Eb (B) – m x Eb (M) – n x Eb (N) (1)
– Tính biến thiển enthalpy của phản ứng dựa vào năng lượng liên kết được áp dụng cho phản ứng trong đó các chất đều có liên kết cộng hoá trị ở thể khí khi biết giá trị năng lượng liên kết của tất cả các chất trong phản ứng.
Bảng 14.1. Năng lượng liên kết của một số liên kết cộng hoá trị
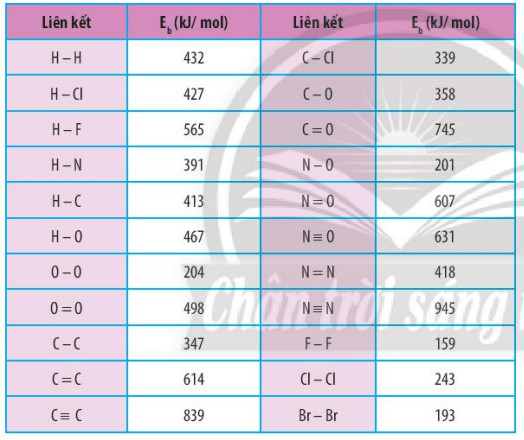
Ví dụ 1: Dựa vào năng lượng liên kết ở Bảng 14.1, tính biến thiện enthalpy của phản ứng:
H2(g) + Cl2(g) → 2HCl(g)
– Bước 1: Tính năng lượng cần thiết để phá vỡ 1 mol H – H và 1 mol Cl – Cl
+ Tổng năng lượng thu vào để phá vỡ các liên kết: Eb (H -H) + Eb (C – C) = 432 +243 = 675 kJ
– Bước 2: Tính năng lượng toả ra khi hình thành 2 mol H – Cl
+ Tổng năng lượng toả ra để hình thành liên kết: 2 x Eb (H-Cl) = 2 x 427 = 854 kJ
– Bước 3: Tính biến thiên enthalpy của phản ứng theo công thức (1)
+ \({\Delta _r}H_{298}^0\) = 675 – 854 = -179 kJ
+ Do \({\Delta _r}H_{298}^0\) < 0 nên phản ứng toả nhiệt.
Ví dụ 2: Tính biến thiên enthanny của phản ứng tạo thành ammonia (sử dụng năng lượng liên kết ở Bảng 14.1). Cho biết phản ứng thu nhiệt hay toả nhiệt và vẽ sơ đồ biểu diễn biến thiên enthalpy của phản ứng.
3H2(g) + N2(g) → 2NH3 (g)
\({\Delta _r}H_{298}^0\) = 3 x Eb (H2) + Eb (N2) – 2 x Eb (NH3)
= 3 x Eb(H – H) + Eb(N – N) – 2 x 3 x Eb(N – H) = 3 x 432 + 945 – 2 x 3 x 391 = -105 kJ.
– Do \({\Delta _r}H_{298}^0\) < 0 nên phản ứng toả nhiệt.
– Sơ đồ biểu diễn biến thiên enthalpy của phản ứng:

Hình 14.2.Sơ đồ biểu diễn biến thiên enthalpy
|
Tổng quát: \({\Delta _r}H_{298}^0 = \sum {E_b}(c{\rm{d}}) – \sum {E_b}(sp)\) Với \(\sum {E_b}(c{\rm{d}})\), \(\sum {E_b}(s{\rm{p}})\): tổng năng lượng liên kết trong phân tử chất đầu và sản phẩm của phản ứng. |
|---|
1.2. Xác định biến thiên Enthalpy của phản ứng dựa vào Enthalpy
– Tính biến thiên enthalpy của phản ứng dựa vào enthalpy tạo thành
– Cho phương trình hoá học tổng quát: aA + bB → MM + nN
– Có thể tính được biến thiên enthalpy chuẩn của một phản ứng hoá học (\({\Delta _r}H_{298}^0\)) khi biết các giá trị \({\Delta _f}H_{298}^0\) của tất cả các chất đầu và sản phẩm theo công thức sau:
\({\Delta _r}H_{298}^0 = m.{\Delta _f}H_{298}^0(M) + n.{\Delta _f}H_{298}^0(N) – a.{\Delta _f}H_{298}^0(A) – b.{\Delta _f}H_{298}^0(B)\) (2)
Ví dụ 3: Cho enthalpy tạo thành chuẩn của các chất tương ứng trong phương trình.
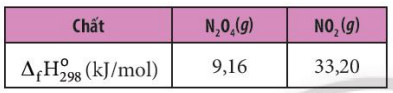
– Tính biến thiên enthalpy của phản ứng sau: 2NO2 (g) → N2O4 (g)
– Theo công thức (2), ta có: \({\Delta _r}H_{298}^0 = {\Delta _f}H_{298}^0({N_2}{O_4}) – 2.{\Delta _f}H_{298}^0(N{O_2})\)= 9,16 – 2 x 33,20 = -57,24 kg
– Do \({\Delta _r}H_{298}^0\) < 0 nên phản ứng toả nhiệt.
Ví dụ 4: Cho nhiệt tạo thành chuẩn của các chất tương ứng trong phương trình.
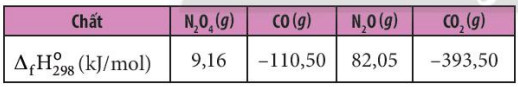
– Tính biến thiên enthalpy của phản ứng sau: N2O4 (g) + 3CO (g) → N2O (g) + 3CO2 (8)
– Theo công thức (2), ta có:
\({\Delta _r}H_{298}^0 = {\Delta _f}H_{298}^0({N_2}O) + 3.{\Delta _f}H_{298}^0(C{O_2}) – {\Delta _f}H_{298}^0({N_2}{O_4}) – 3.{\Delta _f}H_{298}^0(CO)\)
= 82,05 + 3 x (-393,50) – 9,16 – 3x (-110,50) = -776,11 kJ
– Do \({\Delta _f}H_{298}^0\) < 0 nên phản ứng toả nhiệt.
|
Tổng quát: \({\Delta _r}H_{298}^0 = \sum {\Delta _f}H_{298}^0(sp) – \sum {\Delta _f}H_{298}^0(cd)\) Với \(\sum {\Delta _f}H_{298}^0(sp);\sum {\Delta _f}H_{298}^0(cd)\): tổng enthalpy tạo thành ở điều kiện chuẩn tương ứng của sản phẩm, chất đầu của phản ứng. |
|---|