1.1. Xu hướng biến đổi bán kính nguyên tử
a. Trong một chu kì
– Quy luật chung đối với các nguyên tố nhóm A: Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, bán kính các nguyên tử có xu hướng giảm dần.
– Nguyên tử các nguyên tố trong cùng chu kì có cùng số lớp electron. Từ trái sang phải, điện tích hạt nhân nguyên tử tăng dần nên hạt nhân sẽ hút electron lớp ngoài cùng mạnh hơn, làm cho bán kính nguyên tử giảm.
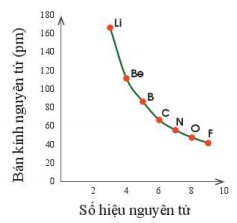
Hình 7.1. Sự thay đổi bán kính nguyên tử theo số hiệu nguyên tử của các nguyên tố chu kì 2
b. Trong một nhóm A.
– Quy luật chung đối với các nguyên tố nhóm A: Trong một nhóm, theo chiều tăng điện tích hạt nhân, bán kính của nguyên tử có xu hướng tăng dần.
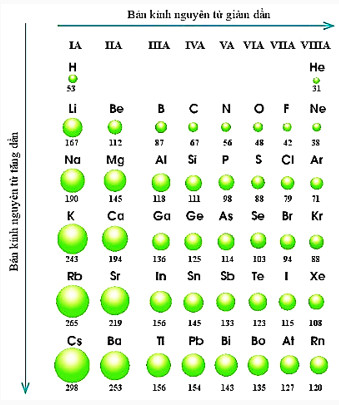
Hình 7.2. Bán kính nguyên tử (pm) của một số nguyên tố trong bảng tuần hoàn
– Trong một nhóm A, theo chiều từ trên xuống dưới, bán kinh nguyên tử tăng dần, nguyên nhân chủ yếu là do số lớp electron tăng dần.
| Bán kính nguyên tử có xu hướng giảm theo chiều tăng điện tích hạt nhân trong một chu kì, có xu hướng tăng theo chiều tăng điện tích hạt nhân trong một nhóm. |
|---|
1.2. Xu hướng biến đổi độ âm điện, tính kim loại và tính phi kim
a. Độ âm điện
– Độ âm điện (x) là đại lượng đặc trưng cho khả năng hút electron liên kết của một nguyên tử trong phân tử.
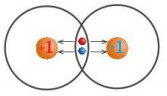
Hình 7.3. Cặp electron liên kết bị các nguyên tử hút về phía các hạt nhân của mỗi nguyên tử H
– Độ âm điện được sử dụng rộng rãi là độ âm điện theo Pauling (Pau-linh). Theo đó, nguyên tử nguyên tố có độ âm điện lớn nhất là fluorine, X(F) = 3,98.
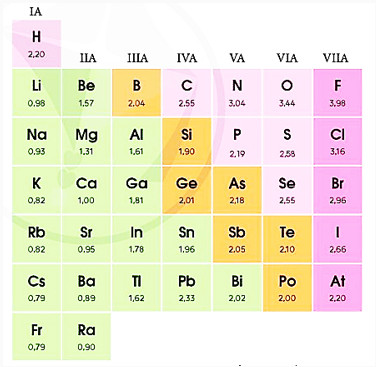
Hình 7.5. Giá trị độ âm điện của một số nguyên tố nhóm A
Ví dụ 1: Độ âm điện của H và N lần lượt là 2,20 và 3,04. Điều này có nghĩa là nguyên tử N hút electron liên kết mạnh hơn nguyên tử H, gấp 3,04 : 2,20 = 1,38 lần. Vậy trong phân tử NH3, các cặp electron liên kết sẽ bị lệch về phía nguyên tử N.
Ví dụ 2: Độ âm điện của 0 là 3,44. Vậy nguyên tử O hút electron liên kết mạnh hơn nguyên tử H, gấp 3,44 : 2,20 = 1,56 lần. Do đó, trong phân tử H2O, các cặp electron liên kết sẽ bị lệch về phía nguyên tử O.
– Quy luật chung đối với các nguyên tố nhóm A:
+ Trong một chu kì, theo chiều tăng điện tích hạt nhân, độ âm điện của các nguyên tử nguyên tố có xu hướng tăng dần.
+ Trong một nhóm, theo chiều tăng điện tích hạt nhân, độ âm điện của các nguyên tử nguyên tố có xu hướng giảm dần.
– Độ âm điện phụ thuộc đồng thời vào hai yếu tố: điện tích hạt nhân và bán kính nguyên tử.
+ Trong một chu kì, từ trái sang phải theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần nên khả năng hút cặp electron liên kết càng mạnh, dẫn tới độ âm điện càng cao.
+ Trong một nhóm, từ trên xuống dưới, theo chiều tăng của điện tích hạt nhân, bán kính nguyên tử tăng lên nên lực hút của hạt nhân tới cặp electron liên kết giảm, dẫn tới độ âm điện giảm.
b. Tính kim loại và tính phi kim
– Tính kim loại đặc trưng bởi khả năng nhường electron của nguyên tử. Tính phi kim đặc trưng bởi khả năng nhận electron của nguyên tử.
– Quy luật chung đối với các nguyên tố nhóm A:
+ Trong một chu kì, theo chiều tăng điện tích hạt nhân, tính kim loại của các nguyên tố có xu hướng giảm dần, tính phi kim của các nguyên tố có xu hướng tăng dần.
+ Trong một nhóm, theo chiều tăng điện tích hạt nhân, tính kim loại của các nguyên tố có xu hướng tăng dần, tính phi kim của các nguyên tố có xu hướng giảm dần.
– Trong một chu kì, từ trái sang phải, điện tích hạt nhân tăng dần, bán kính nguyên tử giảm dần nên lực hút của hạt nhân tới electron hoá trị tăng, làm giảm khả năng nhường electron, do đó tính kim loại của nguyên tố giảm.
– Trong một nhóm A, mặc dù điện tích hạt nhân tăng dần nhưng do bản kinh nguyên tử của các nguyên tố tăng nhanh, nên lực hút của hạt nhân tới electron hoá trị giảm dần, làm tăng khả năng nhường electron, do đó tính kim loại tăng.
– Đối với phi kim, cách giải thích hoàn toàn tương tự như trên.
|
– Độ âm điện của nguyên tử nguyên tố hoá học có xu hướng tăng theo chiều tăng điện tích hạt nhân trong một chu kì, có xu hướng giảm theo chiều tăng điện tích hạt nhân trong một nhóm. – Tính kim loại của nguyên tử nguyên tố hoá học có xu hướng giảm theo chiều tăng điện tích hạt nhân trong một chu kì, có xu hướng tăng theo chiều tăng điện tích hạt nhân trong một nhóm. – Tính phi kim của nguyên tử nguyên tố hoá học có xu hướng tăng theo chiều tăng điện tích hạt nhân trong một chu kì, có xu hướng giảm theo chiều tăng diện tích hạt nhân trong một nhóm. |
|---|
1.3. Xu hướng biến đổi thành phần và tính acid, tính base của các oxide cao nhất trong một chu kì
a. Thành phần và tính acid, tính base của các oxide cao nhất trong một chu kì
– Oxide cao nhất của một nguyên tố là oxide mà nguyên tố trong đó có hoá trị cao nhất. Các nguyên tố thuộc nhóm IA đến VIIA (trừ fluorine) có hoá trị cao nhất đúng bằng số thứ tự của nhóm.
Ví dụ: Li ở nhóm IA, Cl ở nhóm VIIA, vậy hoá trị cao nhất của Li và Cl tương ứng là I và VII.
– Công thức oxide cao nhất và hoá trị tương ứng các nguyên tố nhóm A, chu kì 3 thể hiện trong Bảng 7.1.
Bảng 7.1. Oxide cao nhất của các nguyên tố nhóm A, chu kì 3
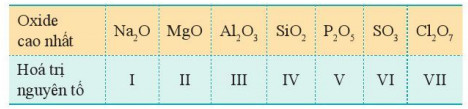
– Xu hướng biến đổi thành phần của các oxide cao nhất: Trong một chu kì, theo chiều tăng điện tích hạt nhân, tỉ lệ số nguyên tử oxygen với số nguyên tử nguyên tố còn lại trong các oxide cao nhất có xu hướng tăng dần.
– Quy luật về sự biến đổi 1 chung của tỉnh acid và tính | base của oxide cao nhất ngược chiều nhau trong mỗi chu kì và mỗi nhóm.
– Xu hướng biến đổi tính acid, tính base của oxide cao nhất: Trong một chu kì, theo chiều tăng điện tích hạt nhân, tính acid của oxide cao nhất có xu hướng tăng dần, tính base của chúng có xu hướng giảm dần.
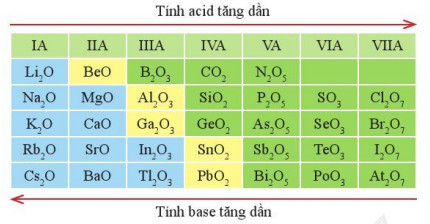
Hình 7.6. Xu hướng biến đổi tính acid, tính base của một số oxide cao nhất
Ví dụ: Trong dãy oxide cao nhất của các nguyên tố chu kì 3: Na2O có tính base mạnh nhất (Na2O là basic oxide); Cl2O7, có tính acid mạnh nhất (Cl2O7 là acidic oxide) và Al2O3 vừa có tính acid, vừa có tính base.
Al2O3+ 2NaOH + 3H2O → 2Na[Al(OH)4]
Al2O3 + 6HCl → 2A1Cl3 + 3H2O
b. Thành phần và tính acid, tính base của các hydroxide trong một chu kì
– Hydroxide của nguyên tố kim loại M hoá trị n có dạng M(OH)n. Đối với nguyên tố phi kim, hydroxide của nó ở dạng acid.
Bảng 7.2. Công thức hydroxide của các nguyên tố nhóm A chu kì 3 (các nguyên tố ở hoá trị cao nhất)
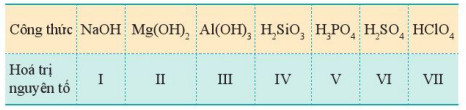
– Xu hướng biến đổi tính acid, tính base của hydroxide: Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, tính acid của các hydroxide có xu hướng tăng dần, tính base của chúng có xu hướng giảm dần.
Ví dụ
– NaOH là một base mạnh.
2NaOH + CO2 → Na2CO3 + H2O
Al(OH)3 có cả tính acid và tính base, có thể phản ứng với cả base và acid.
Al(OH)3 + NaOH → Na[Al(OH)4]
Al(OH)3 + 3HCl → AlCl3 + 3H2O
H2SiO3 là acidrất yếu, H3PO4 là acid trung bình, H2SO4 là acid mạnh, HClO4 là acid rất mạnh.
H3PO4 + 3NaOH → Na3PO4 +3H2O
| Xu hướng biến đổi tính acid, tính base của oxide và hydroxide trong một chu kì: tính acid có xu hướng tăng dần, tính base có xu hướng giảm dần theo chiều tăng điện tích hạt nhân. |
|---|