1.1. Nguyên tố hóa học
a. Khái niệm nguyên tố hoá học
– Nguyên tố hoá học là tập hợp các nguyên tử có cùng số hạt proton.
Ví dụ: Ba loại nguyên tử hydrogen (H) đều có một proton trong hạt nhân nên thuộc cùng một nguyên tố hoá học, nguyên tố hydrogen (H).
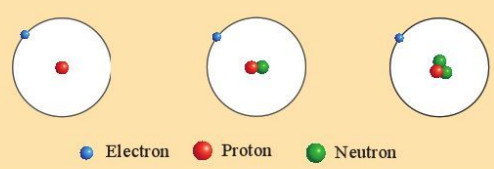
Hình 3.2. Mô hình cấu tạo các loại nguyên tử của nguyên tố hydrogen
– Kim cương và than chì có vẻ bề ngoài rất khác nhau nhưng đều được tạo nên từ các nguyên tử mà hạt nhân có 6 proton. Như vậy, kim cương và than chì đều được tạo nên từ cùng một nguyên tố hoá học, nguyên tố carbon (C).

Hình 3.3. Kim cương và than chì
– Hạt nhân nguyên tử chì (Pb) có 82 proton, hạt nhân nguyên tử vàng có 79 proton. Các tác động vật lí, hoá học thông thường không làm thay đổi hạt nhân nên không thể biến đổi chì thành vàng bằng các cách này được.
1.2. Số hiệu nguyên tử, số khối, kí hiệu nguyên tử
– Số proton trong một hạt nhân nguyên tử được gọi là số hiệu nguyên tử, kí hiệu là Z.
– Ví dụ: Hạt nhân nguyên tử helium (He) có 2 proton, vậy số hiệu nguyên tử của He là 2 (ZHe = 2).
– Tổng số proton (Z) và neutron (N) trong một hạt nhân nguyên tử được gọi là số khối, kí hiệu là A: A = Z + N
– Như vậy, số khối chính bằng tổng số hạt có trong hạt nhân nguyên tử. Giá trị này xấp xỉ bằng giá trị khối lượng nguyên tử (khi tính theo đơn vị amu).
– Kí hiệu nguyên tử \(_Z^AX\) cho biết kí hiệu hoá học của nguyên tố (X), số hiệu nguyên tử (Z) và số khối (A).

Hình 3.4. Kí hiệu nguyên tử của helium
– Đôi khi, người ta viết tắt kí hiệu nguyên tử. Ví dụ: sử dụng He thay cho \(_2^4He\), bởi kí hiệu He đã cho biết đây là nguyên tử nguyên tố helium, hạt nhân có 2 proton.
1.3. Đồng vị, nguyên tử trung bình
a. Đồng vị
– Các nguyên tử của cùng một nguyên tố hoá học có số neutron khác nhau là đồng vị của nhau.
– Do đó, các đồng vị của cùng một nguyên tố hoá học (có cùng số proton) khác nhau về số khối do có số neutron khác nhau.
– Tất cả các nguyên tố hoá học đều có nhiều đồng vị.
Ví dụ: hydrogen có các đồng vị là: 1H (kí hiệu là H), đồng vị, 2H (kí hiệu là D), 3H (kí hiệu là T).., carbon có các đồng vị là 12C, 13C,…
b. Nguyên tử khối trung bình
– Nguyên tử khối là khối lượng tương đối của một nguyên tử, cho biết khối lượng của một nguyên tử nặng gấp bao nhiêu lần 1 amu.
Ví dụ: Nguyên tử khối của 12C là 12 do khối lượng của một nguyên tử 12C là 12 amu.
– Nguyên tử khối trung bình
+ Mỗi nguyên tố hoá học đều có nhiều đồng vị. Trong tự nhiên, một nguyên tố hoá học dù ở dạng đơn chất hay hợp chất thì tỉ lệ giữa các đồng vị của nguyên tố này là không đổi. Nguyên tử khối của nguyên tố hoá học có nhiều đồng vị là nguyên tử khối trung bình của các đồng vị (kí hiệu là \(\overline A \)), có tính đến tỉ lệ số nguyên tử các đồng vị tương ứng (xác định từ phổ khối lượng).
+ Công thức tính nguyên tử khối trung bình như sau:
\(\overline A = \frac{{A.a + B.b + C.c + …}}{{a + b + c + …}}\)
+ Trong đó:
- A, B, C,… lần lượt là số khối của các đồng vị.
- a, b, c,… là phần trăm số nguyên tử các đồng vị tương ứng.
Ví dụ: Trong tự nhiên, bạc có hai đồng vị bền: 107Ag và 109Ag chiếm tương ứng khoảng 51,86% và 48,14% về số nguyên tử. Nguyên tử khối trung bình của bạc là:
\(\frac{{107.51,86 + 109.48,14}}{{51,86 + 51,86}} \approx 107,96\)