1.1. Hydrogen Halide và Hydrohalic Acid
a. Hydrogen Halide
– Hợp chất gồm nguyên tố halogen và nguyên tố hydrogen, có dạng HX, được gọi chung là hydrogen halide. Đây là các hợp chất cộng hoá trị phân cực do sự chênh lệch độ ẩm điện giữa nguyên tử hydrogen với các nguyên tử halogen.
– Sự phân cực được biểu diễn như sau: \({H^{\delta + }}:{X^{\delta – }}\)
– Xu hướng phân cực giảm dần từ HF đến HI.
– Nhiệt độ sôi của các hydrogenhalide được ghi ở Bảng 18.1.
Bảng 18.1. Nhiệt độ sôi của của các hydrogen halide
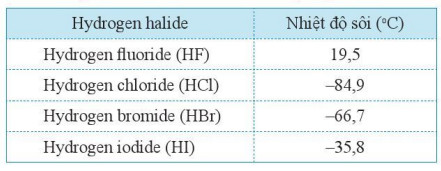
– Giá trị nhiệt độ sôi của các hydrogen halide cho thấy ở điều kiện thường chúng là các chất khí.
– Bảng 18.1 chỉ ra rằng nhiệt độ sôi tăng từ hydrogen chloride đến hydrogen iodide. Xu hướng tăng nhiệt độ sôi này được giải thích bởi hai nguyên nhân.
+ Thứ nhất, sự tăng khối lượng phân tử từ HCl đến HI làm tăng năng lượng cần thiết cho quá trình sôi của chất.
+ Thứ hai, sự tăng kích thước và số lượng electron trong các phân tử từ HCl đến HI làm tăng cường thêm khả năng xuất hiện các lưỡng cực tạm thời trong phân tử. Khi đó làm tăng tương tác van der Waals giữa các phân tử.
– Riêng hydrogen fluoride có nhiệt độ sôi cao bất thường so với các chất còn lại trong dãy. Điều này được giải thích chủ yếu là do giữa các phân tử hydrogen fluoride còn tạo liên kết hydrogen với nhau:
…F-H… F-H… → [HF]n với giá trị trung bình của n từ 5 đến 6.
– Vì tồn tại dưới dạng [HF]n nên hydrogen fluoride khó bay hơi hơn các hydrogen halide còn lại.
b. Hydrohalic acid
– Các hydrogenhalide dễ tan trong nước và phân tử phân cực. Chẳng hạn, ở 20°C, 1 thể tích nước có thể hoàn tan đển 500 thể tích khí hydrogen chloride. Trong dung dịch, hydrogen halide đều phân li ra ion H+ nên được gọi là hydrohalic acid (hay các acid HX).
– Ví dụ, sự phân li của hydrogen chloride trong nước như sau: HCl (aq) → H+ (aq) + Cl– (aq)
– Tính acid của các dung dịch HX tăng theo dãy từ HF đến HI. Trong đó, hydrofluoric acid là acid yếu do chỉ phân li một phần trong nước. Còn hydrochloric acid, hydrobromic acid và hydroiodic acid được xếp vào loại acid mạnh do phân li hoàn toàn trong nước. Nguyên nhân chủ yếu làm tăng độ mạnh của các acid theo dãy trên là do sự giảm độ bền liên kết theo thứ tự HF, HCl, HBr, HI.
|
– Trong dãy hydrogen halide, nhiệt độ sôi tăng dần từ hydrogen chloride dến hydrogen iodide. Riêng hydrogen fluoride có nhiệt độ sôi cao bất thường do các phân tử HF tạo liên kết hydrogen với nhau. – Trong dây các hydrohalic acid, tính acid tăng dần từ hydrofluoric acid (HF) đến hydroiodic acid (HI). |
|---|
1.2. Tính khử của một số ion Halide X–
– Các hợp chất chứa ion Cl–, Br–,I– phản ứng được với sulfuric acid đặc. Tuy nhiên, các sản phẩm là không giống nhau.
– Bảng 18,2 mô tả phản ứng của sodium chloride (chứa Cl–), sodium bromide (chứa Br–) và sodium iodide (chứa I–), đều thể rắn với sulfuric acid đặc.
Bảng 18.2. Phản ứng của một số sodium halide với sulfuric acid đặc, đun nóng

– Từ các phản ứng trên cho thấy khi phản ứng với sulfuric acid đặc thì:
+ Ion Cl– không thể hiện tính khử.
+ Ion Br– thể hiện tính khử và khử sulfur trong H2SO4 từ số oxi hoá +6 về số oxi hoá +4 trong SO2.
+ Ion I– thể hiện tính khử và khử sulfur trong H2SO4 từ số oxi hoá +6 về số oxi hoá -2 trong H2S.
– Vì vậy, khi phản ứng với sulfuric acid đặc, Br– có tính khử yểu hơn I–.
– Thực tế, khi tiếp xúc với các chất oxi hoá khác nhau thì tính khử của ion X– thường tăng từ Cl– đến I–
1.3. Ứng dụng của một số Hydrogen Halide
– Trong các hydrogen halide thi hydrogen fluoride và hydrogen chloride có nhiều ứng dụng phổ biến hơn.
a. Ứng dụng của hydrogen fluoride
– Trước đây, ứng dụng phổ biến của hydrogen fluoride là sản xuất các hợp chất chlorofluorocarbon hay còn gọi là các hợp chất CFC, được sử dụng cho các hệ thống làm lạnh. Tuy nhiên, do tác động phá huỷ tầng ozone nên đầu thế kỉ XXI, các hợp chất CFC đã bị cấm sản xuất. Gần đây, tử hydrogen fluoride, người ta sản xuất hydrochlorofluorocarbon (HCFC) thay thế CFC.
– Một lượng đáng kể hydrogen fluoride được dùng trong sản xuất cryolite (thành phần chính là Na AlF), đóng vai trò “chất chảy” trong quá trình sản xuất nhôm aluminium) từ aluminium oxide Hydrogen fluoride còn được sử dụng trong các quá trình chế biến dầu mỏ, trong công nghiệp hạt nhân, trong sản xuất các fluoride,..
– Dung dịch nước của hydrogen fluoride là hydrofluoric acid có khả năng hoà tan silicon dioxide nên được sử dụng để khắc các chi tiết lên thuỷ tinh theo phản ứng
SiO2 (s) + 4HF(aq) → SiF4(g) + 2H2O(l)
b. Ứng dụng của hydrogen chloride
– Hiện nay, mỗi năm thế giới sản xuất hàng chục triệu tấn hydrochloric acid to hydrogen chloride.
– Lượng lớn hydrogen chloride và hydrochloric acid được sử dụng để sản xuất vinyl chloride cung cấp cho ngành nhựa, ammonium chloride để cung cấp cho ngành sản xuất phân bón, các chloride kim loại để cung cấp cho ngành hoá chất, các hợp chất hữu cơ chửa chlorine để phục vụ sản xuất dược phẩm, thuốc nhuộm.
– Dung dịch nước của hydrogen chloride là hydrochloric acid được dùng để trung hoà môi trưởng base, hoặc thuỷ phân các chất trong các quá trình sản xuất, tẩy rửa gỉ sét (thành phần chính là các iron oxide) bám trên bề mặt của các loại thép. Dưới đây một phản ứng minh hoạ.
Fe2O3(s) + 6HCl(aq) → 2FeCl3(aq) + 3H2O (l)
1.4. Phân biệt các ion Halide X–
– Khi nhỏ dung dịch silver nitrate vào dung dịch acid HX hoặc muối halide, sẽ quan sát được các hiện tượng khác nhau, tuỳ thuộc vào ion halide X–.
– Trong đó:
+ Khi X– là F– thì không thấy hiện tượng xảy ra.
+ Khi X– là Cl– thì xuất hiện kết tủa màu trắng silver chloride (AgCl).
+ Khi X– là Br– thì xuất hiện kết tủa màu vàng nhạt silver bromide (AgBr).
+ Khi X– là I– thì xuất hiện kết tủa màu vàng silver iodide (AgI).
– Với các hiện tượng khác nhau như trên, người ta dùng dung dịch silver nitrate để phân biệt các ion halide.

Hình 18.2. Một số hợp chất silver halide
|
– Khi phản ứng với sulfuric acid đặc, Cl– không thể hiện tính khử, Br– thể hiện tính khử những yếu hơn. – Có thể phân biệt các ion halide X- trong dung dịch bằng silver nitrate. |
|---|