1.1. Giới thiệu về nguyên tố nhóm VIIA
– Các nguyên tố nhóm VIIA gồm: fluorine, chlorine, bromine, iodine và hai nguyên tố phóng xạ là astatine, tennessine. Một số đặc điểm của các nguyên tố halogen được thể hiện trong Bảng 17.1.
Bảng 17.1. Một số đặc điểm của các nguyên tố halogen
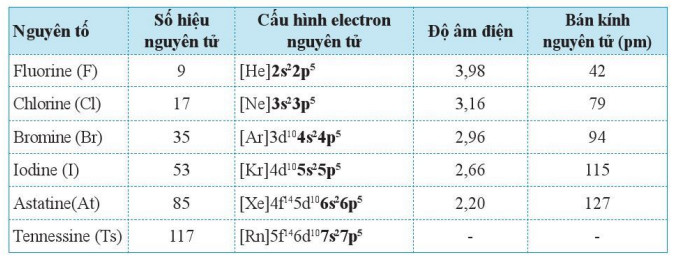
– Mỗi nguyên tử nguyên tố nhóm VIIA đều có 7 electron lớp ngoài cùng, dạng ns2np5. Vì vậy, chúng là các phi kim.
– Trong tự nhiên, các nguyên tố nhóm VIIA chủ yến tồn tại dạng muối, do đó chúng còn được gọi là nhóm halogen
+ Fluorine:
- CaF2 là thành phần chính của quặng fluorite.
- Na3AlF6 là thành phần chính của quặng cryolite.
- Ca5(PO4)3F là thành phần chính của quặng fluorapatite.
+ Chlorine
- NaCl trong mỏ muối.
- Các hợp chất chloride (chứa Cl–) tan trong nước biển, nước sông, trong máu động vật
- KCl.MgCl.6H2O là thành phần chính của khoáng vật canallite.
- NaCl.KCl là thành phần chính của khoảng vật sylvinite.
- HCl trong dịch dạ dày.
+ Bromine: Các hợp chất bromide (chứa Br–) tan trong nước biển, nước sông.
+ Iodine: Các hợp chất iodide, iodate (chứa I–, IO3–) có trong nước biển, nước sông, rong biển.
1.2. Đơn chất Halogen
Ở điều kiện thường, đơn chất halogen tồn tại ở dạng phân tử hai nguyên tử, được kí hiệu chung là X2
a. Xu hướng biến đổi một số tính chất vật lí
– Một số tính chất vật lí của đơn chất halogen được thể hiện Bảng 17.3.
Bảng 17.3. Một số tính chất vật lí của đơn chất halogen
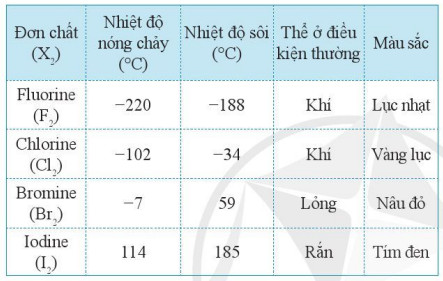
– Khi phân tử X2 có kích thước càng lớn và càng nhiều electron thì tương tác van der Waals giữa các phân tử càng mạnh. Do đó, trong các halogen, tương tác van der Waals tăng từ fluorine đến iodine. Như vậy, bên cạnh sự tăng khối lượng phân tử, thì sự tăng tương tác van der Waals đã giải thích được xu hướng biến đổi nhiệt độ sôi từ fluorine den iodine trong Bảng 17.3.
– Thể của các halogen ở điều kiện thường biển đổi từ khi (fluorine, chlorine) đến lỏng (bromine) và rắn (iodine), phù hợp với xu hướng tăng khối lượng phân tử và sự tương tác giữa các phân tử.
– Một điều lí thú là màu sắc của các đơn chất của halogen từ fluorine đến iodine cũng biến đổi theo xu hướng đậm dần.
b. Xu hướng tạo liên kết trong các phản ứng hoá học
– Nguyên tử của các nguyên tố halogen đều có 7 electron hoá trị. Vì vậy, theo quy tắc octet, halogen thường có hai xu hướng tạo liên kết khi phản ứng với các chất khác.
* Xu hướng thứ nhất: nhận thêm 1 electron từ nguyên tử khác. Xu hướng này xảy ra khi đơn chất halogen phản ứng với nhiều kim loại khác nhau. Khi đó, mỗi nguyên tử Xnhận thêm 1 electron từ nguyên tử kim loại để trở thành anion có điện tích 1-, đồng thời nguyên tử kim loại sẽ trở thành cation có điện tích n+. Cả cation và anion cùng thoả mãn quy tắc octet. Giữa chúng sẽ có tương tác tĩnh điện để tạo hợp chất có liên kết ion.
Ví dụ 1: Khi chlorine phản ứng với magnesium, có sự nhận và nhường electron như sau:
Cl2 + 2e → 2Cl–
Mg → Mg2+ + 2e
– Phương trình hoá học của phản ứng là: Mg (s) + Cl2 (g) → MgCl2 (s)
– Phương trình hoá học của phản ứng là: Mg(s) + Cl2 (8) → MgCl2(s)
* Xu hướng thứ hai: góp chung electron hoá trị với nguyên tử nguyên tố khác. Khi đơn chất halogen phản ứng với một số phi kim thì mỗi nguyên tử X có thể góp chung electron hoá trị với nguyên tử phi kim để cả hai nguyên tử đều đạt cấu hình electron thoả mãn quy tắc octet. Giữa chúng hình thành liên kết cộng hoá trị.
Ví dụ 2: Trong phản ứng giữa chlorine và hydrogen, nguyên tử của mỗi chất sẽ góp chung 1 electron độc thân để hình thành 1 liên kết cộng hoá trị. Khi đó, quanh H có 2 electron như khí hiểm helium, xung quanh C1 có 8 electron như khí hiếm neon, với mô tả theo công thức electron:
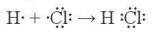
– Phương trình hoá học của phản ứng: H2(g) + Cl2 (g) → 2HCl(g)
– Hai xu hướng trên cho thấy, để thoả mãn quy tắc octet, nguyên tử halogen sẽ dễ nhận thêm 1 electron của nguyên tử khác hoặc góp chung 1 electron với nguyên tử khác.
– Vì vậy:
+ Nhóm halogen có tính phi kim mạnh hơn các nhóm phi kim còn lại trong bảng tuần hoàn.
+ Hoá trị phổ biến của các halogen là I.
c. Xu hướng thể hiện tính oxi hoá
– Ngoại trừ fluorine, các halogen còn lại thể hiện cả tính oxi hoá và tính khử trong các phản ứng hoá học. Tuy nhiên, xu hướng thể hiện tính oxi hoá phổ biến hơn rất nhiều và trở nên đặc trưng hơn so với xu hướng thể hiện tính khử.
– Do vậy, ở các nội dung dưới đây, chúng ta chủ yếu xét xu hưởng biến đổi tính oxi hoá trong dãy halogen.
– Thực nghiệm và lí thuyết đều chỉ ra rằng đơn chất halogen đều có tính oxi hoá mạnh và tính oxi hoá giảm dần từ fluorine đến iodine. a) Phản ứng với hydrogen Các đơn chất halogen đều phản ứng với hydrogen tạo hydrogen halide nhưng trong các điều kiện phản ứng và mức độ thể hiện khác nhau.
* Phản ứng với hydrogen
– Các đơn chất halogen đều phản ứng với hydrogen tạo sẽ có một phần sản phẩm tái hydrogen halide nhưng trong các điều kiện phản ứng và tạo lại các chất ban đầu, theo mức độ thể hiện khác nhau.
Bảng 17.4. Điều kiện và mức độ phản ứng của đơn chất halogen với hydrogen, năng lượng liên kết H-X

– Bảng 17.4 cho thấy, mức độ phản ứng với hydrogen giảm từ fluorine đến iodine, phù hợp với xu hướng giảm tính oxi hoá của dãy halogen từ fluorine đến iodine.
– Các phản ứng đều tạo ra phân tử HX. Giá trị năng lượng liên kết H-X giảm dần làm cho độ bền nhiệt của các phân tử giảm từ HF đến HI.
– Trong đó, phân tử HI có độ bền nhiệt thấp, dễ bị phân huỷ một phần để tái tạo lại iodine và hydrogen theo phản ứng: 2HI(g) ⇔ H2 (g) + I2 (g)
– Vì vậy, phản ứng hydrogen và iodine được trình bày trong Bảng 17.4 là phản ứng hai chiều hay phản ứng thuận nghịch.
* Phản ứng thế halogen
– Khi cho nước chlorine màu vàng rất nhạt vào dung dịch sodium bromide không màu thì tạo ra dung dịch màu vàng nâu.
– Sự chuyển màu được giải thích là do đã có sự hình thành đơn chất bromine theo phản ứng sau: Cl2 (aq) + 2NaBr (aq) → 2NaCl (aq) + Br2 (aq)
– Như vậy, nguyên tố chlorine đã thay thế bromine trong muối sodium bromide.
– Nhìn chung, trong dung dịch, các halogen có tính oxi hoá mạnh hơn sẽ phản ứng với muối halide của halogen có tính oxi hoá yếu hơn để tạo ra các halogen có tính oxi hoá yếu hơn.
– Cũng cần lưu ý rằng trong dung dịch thì fluorine không có phản ứng trên. Đó là do fluorine ưu tiên phản ứng với nước.
* Phản ứng với nước, với dung dịch sodium hydroxide
– Ngoại trừ fluorine, các halogen còn lại khi phản ứng với nước hoặc dung dịch sodium hydroxide (NaOH) đều thể hiện cá tính oxi hoá và tính khử.
– Khi cho các halogen vào nước thì fluorine phản ứng mạnh, chlorine và bromine có phản ứng thuận nghịch với nước, còn iodine tan rất ít và hầu như không phản ứng.
2F2(aq) + 2H2O (l) → O2 (g) + 4HF(aq)
Cl2 (aq) + H2O(l) → HCl(aq) + HClO(aq)
Br2 (aq) + H2O(l) → HBr(aq) + HBrO(aq)
– Phản ứng giữa chlorine và nước là thuận nghịch nên tạo ra dung dịch gồm nước, hydrochloric acid(HCl), hypochlorous acid (HClO, còn được viết là HOCl) cùng chlorine. Dung dịch này còn được gọi là dung dịch nước chlorine, có tính sát khuẩn. Vì vậy, nước chlorine được sử dụng để xử lí vi khuẩn trong các nguồn nước cấp, môi trường, Trong công nghiệp, người ta còn sử dụng phản ứng giữa chlorine với dung dịch sodium hydroxide lạnh (khoảng 15°C) để tạo ra nước Javel có tính oxi hoá mạnh phục vụ cho mục đích sát khuẩn. Phương trình hoá học tạo nước Javel như sau:
Cl2(aq) + 2NaOH(aq) → NaCl(aq) +NaOCl (aq) +H2O (l)

Hình 17.3. Nước Javel dùng để sát khuẩn, tẩy rửa
– Ngoài phản ứng giữa chlorine với dung dịch sodium hydroxide lạnh, người ta còn thực hiện phản ứng trên ở 70°C. Phương trình hoá học phản ứng như sau:
3Cl2 (aq) +6NaOH(aq) → 5NaCl(aq) + NaClO3 (aq)+3H2O (l)
– Phản ứng giữa chlorine và dung dịch sodium hydroxide thuộc loại phản ứng tự oxi hoá, tự khử. Đó là do chlorine vừa giảm số oxi hoá, vừa tăng số oxi hoá.