1.1. Liên kết Hydrogen
– Các phân tử H2O cũng như một số loại phân tử khác chứa hydrogen như HF, NH3… có thể liên kết được với nhau bởi một loại liên kết xuất hiện giữa các phân tử: liên kết hydrogen.
a. Khái niệm
– Liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng. Các nguyên tử có độ âm điện lớn thường gặp trong liên kết hydrogen là N, O, F.
– Liên kết hydrogen thường được kí hiệu là dấu ba chấm (…), rải đều từ nguyên tử H đến nguyên tử tạo liên kết hydrogen với nó.
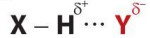
Trong đó, X, Y là các nguyên tử N, O, F.
– Liên kết hydrogen có bản chất tĩnh điện. Tương tác hút tĩnh điện giữa \({H^{\delta + }}\) và \({Y^{\delta – }}\) thể hiện bản chất của liên kết hydrogen.
Ví dụ 1
Liên kết hydrogen được tạo ra giữa hai phân tử nước (Hình 12.2).
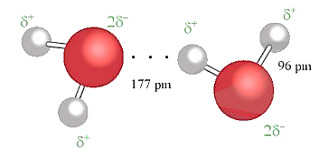
Hình 12.2. Liên kết hydrogen giữa hai phân tử nước
Ta thấy, ở khoảng cách 177 pm, lớn hơn độ dài liên kết cộng hoá trị 0 – H (96 pm), đã xuất hiện liên kết hydrogen.
Ví dụ 2
Ở nhiệt độ thấp, hydrogenfluoride (HF) tồn tại thể rắn dưới dạng polimer (HF)n nhà liên kết hydrogen.
… F – H …F – H…
Hình 12.3. Sơ đồ liên kết hydrogen giữa các phân tử hydrogen fluoride
b. Ảnh hưởng của liên kết hydrogen tới tính chất vật lí của nước
– Đặc điểm tập hợp
+ Nhờ liên kết hydrogen, các phân tử nước có thể tập hợp với nhau, ngay cả ở thể hơi, thành một cụm phân tử. Kích thước các cụm phân tử này thay đổi tùy theo điều kiện nhiệt độ, áp suất. Đặc điểm này khác hẳn so với hầu hết các chất khác.
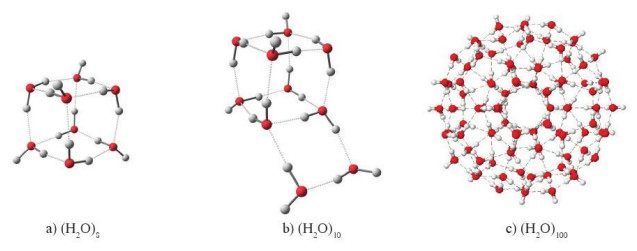
Hình 12.4. Một số cụm phân tử nước
– Nhiệt độ nóng chảy và nhiệt độ sôi
+ Tại áp suất 1 bar, nước có nhiệt độ nóng chảy và nhiệt độ sôi tương ứng là 0°C và (xấp xỉ) 100oC, cao hơn so với nhiều chất có khối lượng phân tử lớn hơn nước (Bảng 12.1). Tính chất này là do các phân tử nước liên kết khá chặt chẽ với nhau bởi các liên kết hydrogen.
Bảng 12.1. Nhiệt độ nóng chảy và nhiệt độ sôi của một số chất ở áp suất 1 bar
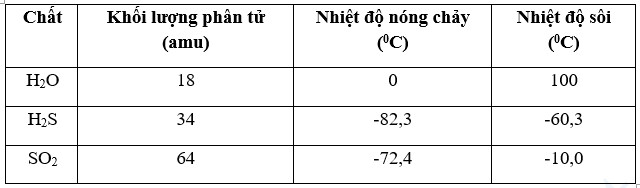
|
Liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng. Các nguyên tử có độ âm điện lớn thường gặp trong liên kết hydrogen là N, O, F. |
|---|
1.2. Tương tác Van Der Waals
– Mặc dù có lực liên kết rất yếu, nhưng tương tác van der Waals lại có nhiều ảnh hưởng trong thực tiễn. Ví dụ: sự bám hút của các hạt bụi lên bề mặt nhẵn, sự hấp phụ các phân tử chất màu và chất độc hại trong nước bởi than hoạt tính,…
a. Khái niệm
– Tương tác van der Waals là một loại liên kết rất yếu, hình thành do lực hút tĩnh điện giữa các cực trái dấu của phân tử.
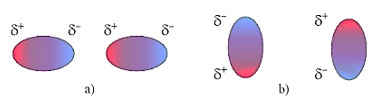
Hình 12.5. Các khả năng tương tác hút tĩnh điện giữa các cực trái dấu của hai phân tử
– Liên kết cộng hoá trị có cực là nguyên nhân dẫn tới sự phân cực ở các phân tử HCl, SO2,…
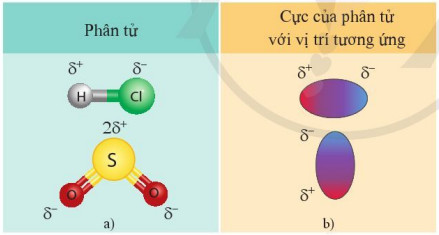
Hình 12.6. Một số phân tử có cực (a) và biểu diễn các cực của phân tử (b)
b. Ảnh hưởng của tương tác van der Waals tới tính chất vật lí của các chất
– Tương tự liên kết hydrogen, tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi các chất, nhưng ở mức độ ảnh hưởng yếu hơn so với liên kết hydrogen.
|
– Tương tác van der Waals là một loại liên kết rất yếu, tạo thành bởi tương tác hút tĩnh điện giữa các cực trái dấu của phân tử. – Liên kết hydrogen và tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất. Trong đó, liên kết hydrogen có ảnh hưởng mạnh hơn. |
|---|