1.1. Khái niệm về alkene và alkyne
a. Khái niệm về alkene, alkyne
– Ethene CH2=CH2, propene CH2=CH-CH3, … có cấu tạo và tính chất hoá học tương tự nhau, lập thành dãy đồng đẳng gọi là alkene.
– Ethyne CH\(\equiv \)CH, propyne CH\(\equiv \)C-CH3, … có cấu tạo và tính chất hoá học tương tự nhau, lập thành dãy đồng đẳng gọi là alkyne.
– Alkene là những hydrocarbon mạch hở, chỉ chứa các liên kết đơn và một liên kết đôi C=C trong phân tử, có công thức chung CnH2n (n≥2).
– Alkyne là những hydrocarbon mạch hở, chỉ chứa các liên kết đơn và một liên kết ba C=C trong phân tử, có công thức chung CnH2n–2 (n≥2).
b. Đặc điểm liên kết, hình dạng phân tử của ethylene và acetylene
– Trong phân tử ethylene, 2 nguyên tử carbon chứa liên kết đôi cùng 4 nguyên tử hydrogen đều nằm trên một mặt phẳng (gọi là mặt phẳng phân tử), các góc HCH và HCC gần bằng 120° (Hình 13.1).
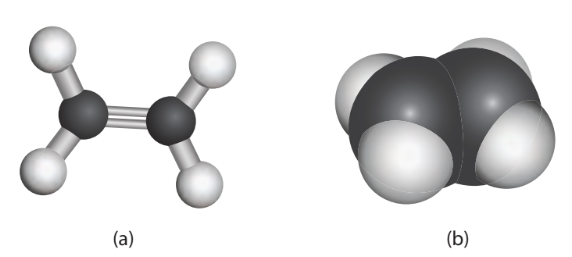
Hình 13.1. Mô hình quả cầu – thanh nối (a) và mô hình đặc (b) của phân tử ethylene
– Trong phân tử acetylene, 2 nguyên tử carbon chứa liên kết ba cùng 2 nguyên tử hydrogen đều nằm trên một đường thẳng (Hình 13.2).
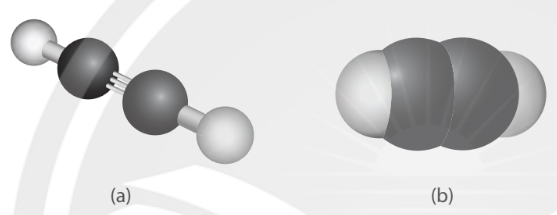
Hình 13.2. Mô hình quả cầu – thanh nối (a) và mô hình đặc (b) của phân tử acetylene
| Phân tử alkene và alkyne chứa liên kết \(\pi\) kém bền hơn liên kết \(\sigma\) |
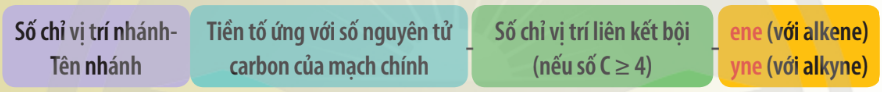
1.2. Danh pháp alkene và alkyne
a. Danh pháp thay thế
– Tên theo danh pháp thay thế của alkene hoặc alkyne không phân nhánh

Ví dụ:
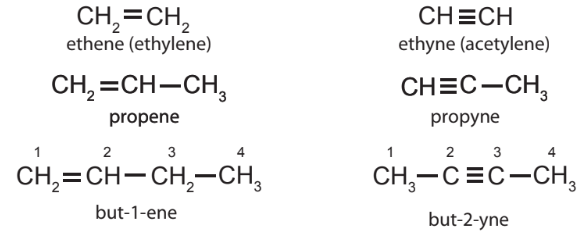
– Tên theo danh pháp thay thế của alkene hoặc alkyne phân nhánh
Ví dụ:

1.3. Đồng phân hình học
– Do sự có mặt của liên kết \(\pi\), các nguyên tử carbon của liên kết đôi C=C không thể quay tự do quanh trục nối giữa hai nguyên tử như đối với trường hợp liên kết đơn C-C (Hình 13.3). Đây là lí do dẫn đến đồng phân cis-, trans- ở một số hợp chất có liên kết đôi C=C (Hình 13.4).
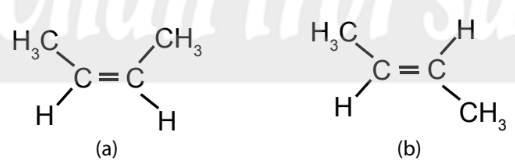
Hình 13.3. Alkene (a) và alkene (b) là đồng phân cis-, trans- của nhau
– Trong phân tử alkene (a), 2 nhóm CH2 nằm ở cùng một phía của liên kết đôi, còn trong alkene (b), 2 nhóm CH2 nằm ở hai phía của liên kết đôi. Hai alkene này là đồng phân hình học dạng cis-/trans- (Hình 13.4).
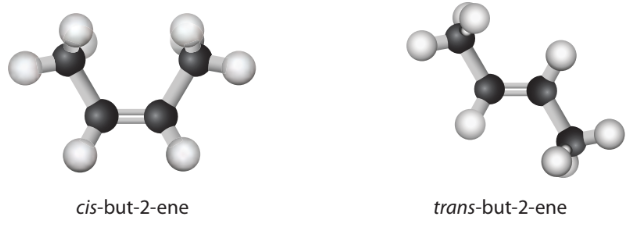
Hình 13.4. Đồng phân cis- và trans- của but-2-ene
1.4. Tính chất vật lí
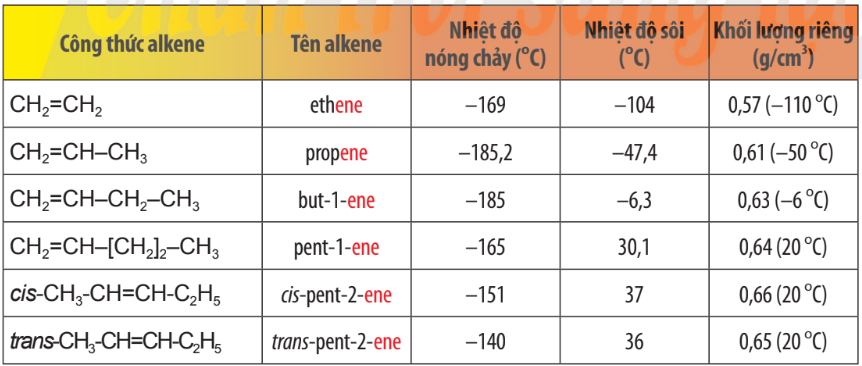
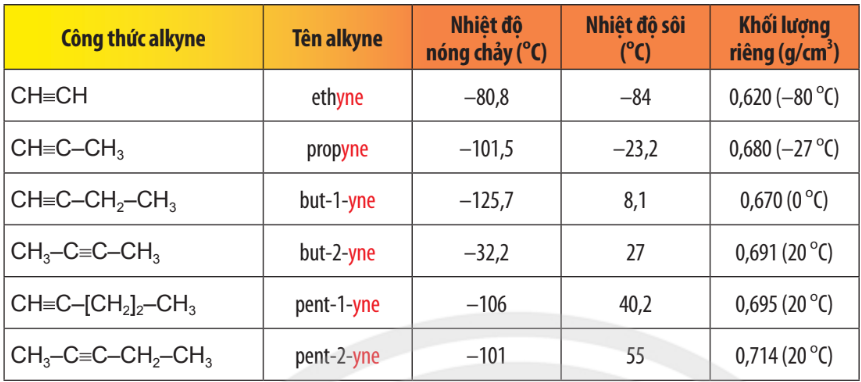
– Nhiệt độ sôi, nhiệt độ nóng chảy và khối lượng riêng của alkene, alkyne không khác nhiều với alkane tương ứng. Các alkene, alkyne là những hợp chất không có mùi và đều nhẹ hơn nước.
– Ở nhiệt độ thường, phần lớn các alkene và alkyne từ C2 đến C4 ở trạng thái khí (trừ but–2–yne ở thể lỏng), từ C5 đến C17 ở trạng thái lỏng và từ C18 trở lên ở trạng thái rắn.
– Chúng không tan hoặc rất ít tan trong nước, tan trong một số dung môi hữu cơ.
Bảng 13.1.Tên gọi và tính chất vật lí của một số alkene
Bảng 13.2.Tên gọi và tính chất vật lí của một số alkyne
1.5. Tính chất hoá học
| Do đều chứa liên kết \(\pi\) kém bền trong phân tử, alkene và alkyne có phản ứng đặc trưng là phản ứng cộng. |
a. Phản ứng cộng
Cộng hydrogen
– Khi có mặt xúc tác như Ni, Pd hoặc Pt ở nhiệt độ thích hợp, alkene và alkyne tác dụng với hydrogen tạo alkane tương ứng.
Ví dụ:
CH=CH + H2 \(\xrightarrow{Ni,\,{{t}^{0}},p}\) CH3-CH3
CH \(\equiv \)CH + 2H2 \(\xrightarrow{Ni,\,{{t}^{0}},p}\) CH3-CH3
– Phản ứng của alkyne xảy ra qua 2 giai đoạn. Nếu dùng xúc tác Lindlar, phản ứng dừng ở giai đoạn tạo alkene.
Hỗn hợp gồm Pd, CaCO3, Pb(CH3COO)2 và quinoline (chất lỏng không màu, công thức C9H7N) do nhà bác học Herbert Lindlar tìm ra.
Ví dụ: CH \(\equiv \)CH + H2 \(\xrightarrow{Ni,\,{{t}^{0}},p}\) CH3-CH3
Cộng halogen
– Ethylene và acetylene đều có khả năng làm mất màu nước bromine ở điều kiện thường.
Ví dụ:

– Phản ứng của acetylene và các alkyne với bromine cũng xảy ra qua 2 giai đoạn.
Cộng hydrogen halide
– Alkene dễ phản ứng với hydrogen halide hơn so với alkyne.
Ví dụ:

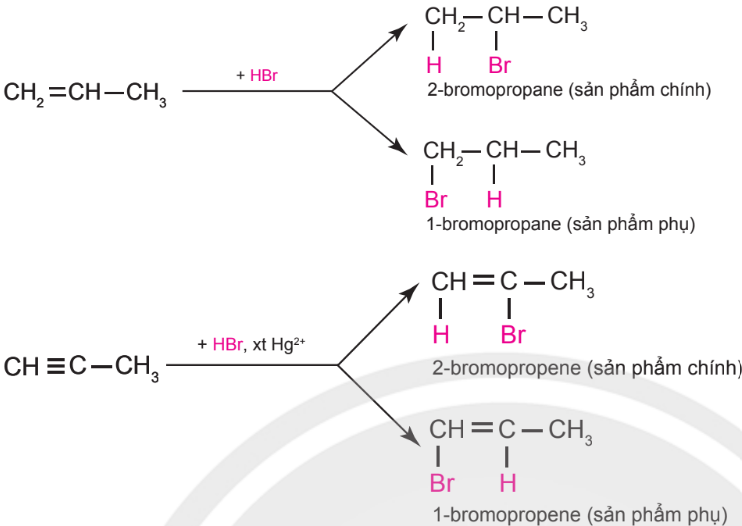
– Alkene hoặc alkyne không đối xứng tác dụng với hydrogen halide (HX) tạo thành hỗn hợp sản phẩm, trong đó sản phẩm chính tuân theo quy tắc Markovnikov: “Nguyên tử hydrogen ưu tiên cộng vào nguyên tử carbon chưa no có nhiều hydrogen hơn, còn nguyên tử X ưu tiên cộng vào nguyên tử carbon chưa no có ít hydrogen hơn”.
Ví dụ:
Cộng nước (hydrate hoá)
– Ở nhiệt độ thích hợp và xúc tác là acid, alkene cộng nước tạo thành alcohol.
Ví dụ:

– Phản ứng của alkyne với nước xảy ra khó hơn, cần xúc tác là muối Hg2+ trong môi trường acid và tạo thành aldehyde hoặc ketone.
Ví dụ:
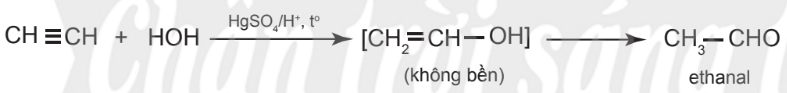
– Nếu alkene hoặc alkyne không đối xứng, phản ứng cũng tạo hỗn hợp hai sản phẩm, trong đó sản phẩm chính tuân theo quy tắc Markovnikov.
| Alkene, alkyne đều có khả năng tham gia phản ứng cộng với H2, X2, HX, H2O,… (X là Cl, Br). |
b. Phản ứng trùng hợp
– Dưới áp suất, xúc tác và nhiệt độ thích hợp, các alkene có thể tham gia phản ứng cộng liên tiếp các phân tử với nhau thành phân tử có khối lượng phân tử rất lớn, gọi là polymer.
Ví dụ:

c. Phản ứng oxi hoá
– Các alkene và alkyne đều bị oxi hoá bởi dung dịch KMnO4 ở điều kiện thường.
3C2H4 + 2KMnO4 + 4H2O → 3C2H(OH)2 + 2KOH + 2MnO2↓
3C2H2 + 8KMnO4 → 3KOOC-COOK + 2KOH + 8MnO2 + 2H2O
– Các alkene, alkyne đều có phản ứng cháy và toả nhiều nhiệt.
\({{\text{C}}_{\text{n}}}{{\text{H}}_{\text{2n}}}\text{+ }\frac{\text{3n}}{\text{2}}{{\text{O}}_{\text{2}}}\xrightarrow{{{t}^{0}}}\text{nC}{{\text{O}}_{\text{2}}}\text{+ n}{{\text{H}}_{\text{2}}}\text{O}\)
\({{\text{C}}_{\text{n}}}{{\text{H}}_{\text{2n-2}}}\text{+ }\frac{\text{3n-1}}{\text{2}}{{\text{O}}_{\text{2}}}\xrightarrow{{{t}^{0}}}\text{nC}{{\text{O}}_{\text{2}}}\text{+ (n-1)}{{\text{H}}_{\text{2}}}\text{O}\)
d. Phản ứng của riêng alk-1-yne
CH\(\equiv \)CH + AgNO3 + NH3 \(\to\) Ag-C\(\equiv \)C-Ag + 2NH4NO3
– Kết tủa Ag-C\(\equiv \)C-Ag có màu vàng nhạt.
– Phản ứng này dùng để nhận biết các alkyne có liên kết ba ở đầu mạch.
1.6. Ứng dụng và cách điều chế alkene, alkyne
a. Ứng dụng

b. Điều chế
– Trong phòng thí nghiệm, alkene được điều chế bằng cách dehydrate alcohol no, đơn chức, mạch hở tương ứng.
Ví dụ: C2H5OH \(\xrightarrow{{{H}_{2}}S{{O}_{4}}dac,\,{{170}^{0}}C}\) C2H4 + H2O
– Acetylene được điều chế trong phòng thí nghiệm bằng cách cho đất đèn (chứa calcium carbide) tác dụng với nước.
CaC2 + H2O → Ca(OH)2 + C2H2
– Trong công nghiệp, alkene thu được từ quá trình cracking alkane.
Ví dụ: C15H32 \(\xrightarrow[{{500}^{0}}C]{Zeolite}\) C3H6 + C8H18
– Acetylene được điều chế trong công nghiệp từ CaC2 hoặc từ CH4
Ví dụ: 2CH4 \(\xrightarrow[lam\,\,lanh\,nhanh]{{{1500}^{0}}C}\) C2H2 + 3H2