1.1. Sulfuric acid
a. Tính chất vật lí

Hình 7.1. Sulfuric acid
| Sulfuric acid là chất lỏng sánh như dầu, không màu, không bay hơi, nặng gần gấp hai lần nước (H2SO4 98% có khối lượng riêng là 1,84 g/cm). |
b. Cấu tạo phân tử, tính chất hoá học và ứng dụng
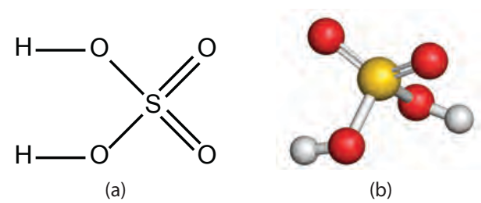
Hình 7.2. Cấu tạo phân tử sulfuric acid (a) và mô hình phân tử sulfuric acid (b)
| Dung dịch H2SO4 loãng có những tính chất chung của acid như làm quỳ tím hoá đỏ, tác dụng với kim loại, base, muối, … |

Hình 7.3. Phản ứng của dung dịch sulfuric acid loãng với (a) dung dịch Ba(OH)2, (b) dung dịch Na2CO3
| Ngoài tính acid mạnh, dung dịch H2SO4 đặc và nóng còn có tính oxi hoá rất mạnh. |
– Dung dịch sulfuric acid đặc có thể lấy nước của nhiều hợp chất hữu cơ có trong da, giấy, đường, tinh bột, …
C12H22O11 \(\xrightarrow{{{H}_{2}}S{{O}_{4}}}\) 12C + H2SO4.11H2O
– Khi bị dung dịch H2SO4 đặc bắn vào người, sẽ gây bỏng nặng. Do vậy, phải rất thận trọng khi làm việc với dung dịch H2SO4 đặc.
– Sulfuric acid đặc hấp thụ mạnh hơi nước nên thường được dùng để làm khô những khí không tương tác hoá học với nó.
– Hằng năm, các nước trên thế giới sản xuất một lượng rất lớn sulfuric acid để dùng trong sản xuất phân bón, thuốc trừ sâu, chất tẩy rửa tổng hợp, tơ sợi hoá học, chất dẻo, sơn màu, …

Hình 7.4. Một số ứng dụng của sulfuric acid
c. Cách bảo quản, sử dụng và nguyên tắc xử lí sơ bộ khi bỏng acid
| Cần bảo quản sulfuric acid trong các bình kín và đặt ở nơi khô ráo, thoáng mát; không đặt gần nơi có các chất khử, kim loại nhẹ. |
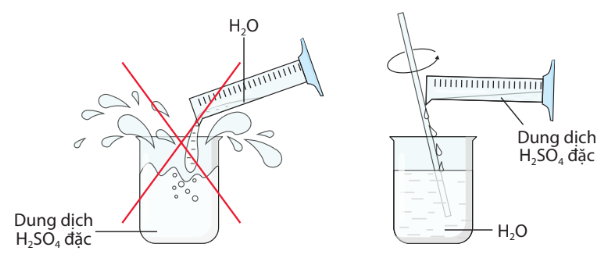
Hình 7.5. Cách pha loãng dung dịch H2SO4 đặc
– Khi bị bỏng acid, cần nhanh chóng bỏ quần áo bị dính acid, sau đó rửa ngay bằng nước sạch khoảng 20 phút.
– Sau đó, cần nhanh chóng chuyển người bị bỏng đến cơ sở y tế gần nhất để được theo dõi và điều trị.
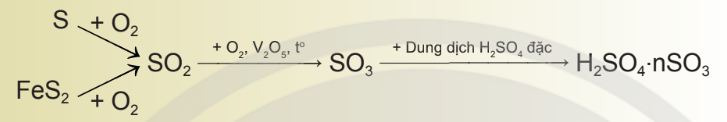
d. Quy trình sản xuất sulfuric acid theo phương pháp tiếp xúc
Sulfuric acid được sản xuất trong công nghiệp bằng phương pháp tiếp xúc.
– Phương pháp này gồm ba giai đoạn chính:
+ Giai đoạn 1: Sản xuất sulfur dioxide (SO2)
+ Giai đoạn 2: Sản xuất sulfur trioxide (SO3)
+ Giai đoạn 3: Sản xuất sulfuric acid (H2SO4)
– Sơ đồ các phản ứng được biểu diễn như sau:
1.2. Muối sulfate
Ứng dụng của một số muối sulfate và nhận biết sulfate ion
– Muối sulfate có nhiều ứng dụng trong đời sống và sản xuất.
+ Calcium sulfate (CaSO4) được dùng trong sản xuất vật liệu xây dựng; làm chất phụ gia để làm đông các sản phẩm như đậu hũ, đậu non; …
+ Barium sulfate (BaSO4) được sử dụng như một loại bột màu làm phụ gia pha màu cho công nghiệp sơn; cho thuỷ tinh, cho gốm sứ cách điện và cao su chất lượng cao, …
+ Magnesium sulfate (MgSO4) được sử dụng sản xuất muối tắm; làm giảm dịu cơ bắp khi sưng tấy cho con người; bổ sung magnesium cho tôm, cá, động vật thuỷ sinh khác; …
+ Ammonium sulfate (NH4)2SO4 là thành phần của thuốc trừ sâu hoà tan, thuốc diệt nấm; phân bón, sử dụng kết hợp với chlorine để tạo monochloramine để khử trùng trong nước uống; …
+ Muối sulfate là những hợp chất quan trọng, được ứng dụng trong nhiều ngành công nghiệp.
– Thuốc thử để nhận biết ion sulfate SO42– trong dung dịch H2SO4 hoặc trong dung dịch muối sulfate) là ion Ba2+ (trong dung dịch muối barium hoặc dung dịch Ba(OH)2).
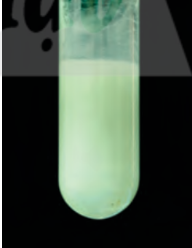
Hình 7.6. Phản ứng của dung dịch BaCl2 với dung dịch Na2SO