1.1. Trạng thái tự nhiên
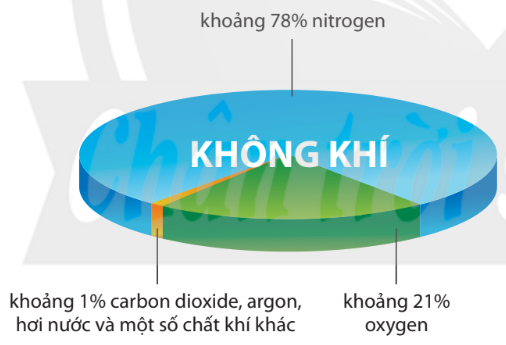
Hình 3.1. Thành phần thể tích của không khí
– Ở trạng thái tự nhiên, nitrogen tồn tại ở dạng đơn chất và hợp chất.
– Ở dạng đơn chất, nitrogen chiếm khoảng 78% thể tích của không khí.
– Nitrogen trong tự nhiên là hỗn hợp của hai đồng vị: 14N (99,63%) và 15N (0,37%).
– Ở dạng hợp chất, nitrogen có nhiều trong khoáng vật sodium nitrate (NaNO3) với tên gọi là diêm tiêu natri.
–Nitrogen còn có trong thành phần của protein, nucleic acid, … và nhiều hợp chất hữu cơ khác.
1.2 Tính chất vật lí
Hình 3.3. Mô hình phân tử nitrogen và năng lượng liên kết trong phân tử nitrogen
– Ở điều kiện thường, nitrogen là chất khí không màu, không mùi, không vị, hơi nhẹ hơn không khí, hoá lỏng ở –196°C và hoá rắn ở –210°C.
– Khí nitrogen tan rất ít trong nước (ở điều kiện thường, 1 lít nước hoà tan được 0,015 lít khí nitrogen).
– Nitrogen không duy trì sự cháy và sự hô hấp.
1.3. Tính chất hoá học
– Nguyên tử nitrogen có độ âm điện lớn, chỉ kém fluorine, oxygen, chlorine.
– Ở nhiệt độ cao, nitrogen có thể tác dụng được với nhiều chất.

Hình 3.3. Mô hình phân tử nitrogen và năng lượng liên kết trong phân tử nitrogen
Tác dụng với hydrogen:
– Ở nhiệt độ cao (380°C – 450°C), áp suất cao (25 bar – 200 bar) và có xúc tác Fe, nitrogen tác dụng với hydrogen tạo khí ammonia.

Tác dụng với oxygen:
– Ở nhiệt độ khoảng 3000°C, nitrogen tác dụng với oxygen tạo thành khí nitrogen monoxygende.
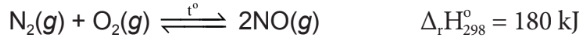
| Ở nhiệt độ thường, phân tử nitrogen rất bền, khá trơ về mặt hoá học. Trong các điều kiện thích hợp, nitrogen chủ yếu thể hiện tính oxi hoá, nitrogen thể hiện tính khử khi tác dụng với oxygen. |
1.4. Quá trình tạo và cung cấp nitrate cho đất từ nước mưa
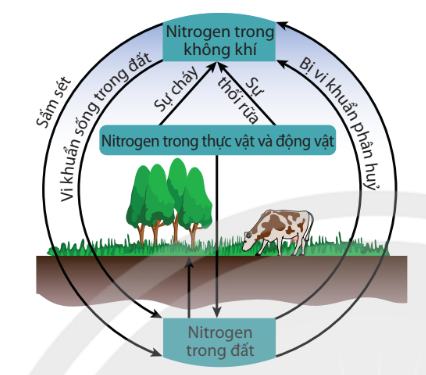
Hình 3.4. Chu trình của nitrogen trong tự nhiên
| Nguyên tố nitrogen rất cần thiết cho sự sống trên Trái Đất. Trong tự nhiên luôn diễn ra các quá trình chuyển hoá nitrogen từ dạng này sang dạng khác theo một chu trình tuần hoàn khép kín. |
1.5. Ứng dụng


Hình 3.5. Một số ứng dụng của nitrogen
