1.1. Ý nghĩa về dấu và giá trị của biến thiên Enthalpy phản ứng
– Với các phản ứng có kèm theo sự trao đổi năng lượng dưới dạng nhiệt, có hai khả năng sau đây:
+ Phản ứng toả nhiệt biến thiên enthalpy của phản ứng có giá trị âm. Biến thiên enthalpy càng âm, phản ứng toả ra càng nhiều nhiệt.
+ Phản ứng thu nhiệt, biến thiên enthalpy của phản ứng có giá trị dương. Biến thiên enthalpy càng dương, phản ứng thu vào càng nhiều nhiệt.
– Với phản ứng toả nhiệt, năng lượng của hệ chất phản ứng cao hơn năng lượng của hệ sản phẩm, do vậy phản ứng diễn ra kèm theo sự giải phóng năng lượng dưới dạng nhiệt. Ngược lại, với phản ứng thu nhiệt, năng lượng của hệ chất phản ứng thấp hơn năng lượng của hệ sản phẩm, do vậy phản ứng diễn ra kèm theo sự hấp thu năng lượng dưới dạng nhiệt.
Ví dụ: Cho phản ứng đốt cháy methane và acetylene:
(1) CH4 (g) +2O2 (g) → CO2 (g) + 2H2O (l) \({\Delta _r}H_{298}^0\) = -890,5 kJ
(2) C2H2 (g) + 5/2O2 (g) → 2CO2 (g) + H2O (l) \({\Delta _r}H_{298}^0\) = -1300,2 kJ
– Với chất khí trong cùng điều kiện nhiệt độ và áp suất, tỉ lệ về số mol bằng tỉ lệ thể tích nên khi đốt cháy cùng một thể tích khi CH4 và C2H2 lượng nhiệt do C2H2 sinh ra nhiều gấp khoảng 1,5 lần lượng nhiệt do CH4 sinh ra. Đây là lí do trong thực tế, người ta sử dụng C2H2 trong đèn xì hàn, cắt kim loại mà không dùng CH4.

Hình 15.1. Đèn xi acetylene dùng để hàn, cắt kim loại
– Đối với các phản ứng toả nhiệt, một số phản ứng cần phải khơi mào. Chẳng hạn phải đốt nóng để gây phản ứng cho một lượng nhỏ chất ban đầu trong các phản ứng chảy, nổ,…), sau đó, phản ứng toả nhiệt có thể tự tiếp diễn mà không cần tiếp tục đun nóng.
– Một số phản ứng không cần có giai đoạn khơi mào (ví dụ phản ứng tạo gỉ sắt, gỉ đồng, phản ứng trung hoà acid – base,…).
– Trái lại, phần lớn các phản ứng thu nhiệt diễn ra cần phải cung cấp năng lượng từ nguồn bên ngoài: ví dụ phản ứng nung vôi cần nhiệt từ quá trình đốt cháy than chẳng hạn, nếu dừng cung cấp nhiệt thì phản ứng nung vôi sẽ không tiếp diễn.
– Một số phản ứng thu nhiệt diễn ra bằng cách lấy nhiệt từ môi trường bên ngoài, nên làm cho nhiệt độ của môi trường xung quanh giảm đi.
Bảng 15.1. So sánh hai loại phản ứng

– Các phản ứng toả nhiệt (\({\Delta _r}H_{298}^0\) < 0) thường diễn ra thuận lợi hơn các phản ứng thu nhiệt (\({\Delta _r}H_{298}^0\) > 0).
Ví dụ: Sau khi được đốt nóng, Na tự chảy trong oxygen cho đến hết do phản ứng này có \({\Delta _r}H_{298}^0\) rất ấm.
2Na(s) + 1/2 O2(g) → Na2O (s) \({\Delta _r}H_{298}^0\) = – 417,98 kJ
– Phản ứng này diễn ra thuận lợi hơn rất nhiều so với phản ứng giữa I2, với H2. Ở điều kiện chuẩn, phản ứng chỉ xảy ra khi được đốt nóng (cung cấp nhiệt), dừng đốt nóng, phản ứng sẽ dừng lại.
1/2H2 (g) + 1/2I2 (s) → HI(g) \({\Delta _r}H_{298}^0\) = 26,5 kJ
|
– Nếu biến thiên enthalpy phản ứng là âm (\({\Delta _r}H_{298}^0\) < 0) thì phản ứng đó toả nhiệt. Giá trị \({\Delta _r}H_{298}^0\) càng âm, phản ứng toả ra càng nhiều nhiệt. – Nếu biến thiên enthalpy phản ứng là dương (\({\Delta _r}H_{298}^0\) > 0) thì đó là phản ứng thu nhiệt. Giá trị \({\Delta _r}H_{298}^0\) càng dương, phản ứng càng thu nhiều nhiệt. |
|---|
1.2. Cách tính biên thiên Enthalpy phản ứng
Có hai cách tính \({\Delta _r}H_{298}^0\), phổ biến là dựa theo enthalpy tạo thành hoặc dựa theo năng lượng liên kết.
a. Tính biến thiên enthalpy phản ứng theo enthalpy tạo thành
– Giả sử có phản ứng tổng quát: aA + bB → mM+ nN
– Biến thiên enthalpy chuẩn của phản ứng này được tính theo công thức:
\({\Delta _r}H_{298}^0 = \,m.{\Delta _f}H_{298}^0(M) + n.{\Delta _f}H_{298}^0(N) – a.{\Delta _f}H_{298}^0(A) – b.{\Delta _f}H_{298}^0(B)\)
Ví dụ 1: Cho phản ứng: 2NaCl(s) → 2Na(s) + Cl2 (g)
– Biến thiên enthalpy của phản ứng này được tính như sau:
\({\Delta _r}H_{298}^0 = \,2.{\Delta _f}H_{298}^0(Na) + 1.{\Delta _f}H_{298}^0(C{l_2}) – 2.{\Delta _f}H_{298}^0(NaCl)\)
– Thay các giá trị tương ứng:
\({\Delta _r}H_{298}^0\) = 2.0+ 1.0 – 2.(-411,2)= 822,4 kJ.
– Do \({\Delta _r}H_{298}^0\) của phản ứng này rất dương nên phản ứng thu nhiệt và muối ăn không bị phân huỷ thành Cl2 (khí độc) và Na khi bị đun nóng thông thường như trong các quá trình nấu thức ăn.
Ví dụ 2: Biến thiên enthalpy của phản ứng đốt cháy hoàn toàn 1 mol octane (C8H8 thành phần chính trong các loại xăng, \({\Delta _r}H_{298}^0\) (C8H8,g)= 208,5 kJ mol-1) được tính như sau:
C8H18 (g) + 25/2 O2(g) → 8CO2 (g) + 9H2O(l)
\({\Delta _r}H_{298}^0 = \,8.{\Delta _f}H_{298}^0(C{O_2}) + 9.{\Delta _f}H_{298}^0({H_2}O) – 1.{\Delta _f}H_{298}^0({C_8}{H_{18}}) – \frac{{25}}{2}.{\Delta _f}H_{298}^0({O_2})\)
– Thay các giá trị tinh được \({\Delta _r}H_{298}^0\) = -5 928,7 kJ. Giá trị này rất âm nên phản ứng đốt cháy octane toả nhiệt mạnh, rất thuận lợi và cung cấp nhiều năng lượng Phản ứng đốt cháy xăng xảy ra dễ dàng.
b. Tính biến thiên enthalpy phản ứng theo năng lượng liên kết
– Khi các chất trong phản ứng ở thể khỉ, biến thiên enthalpy phản ứng cũng có thể tính được nếu biết giá trị năng lượng liên kết của tất cả các chất trong phản ứng.
– Giả sử có phản ứng tổng quát: aA(g) +bB(g) → mM(g) + nN(g)
– Biến thiên enthalpy chuẩn của phản ứng này tỉnh được theo công thức:
\({\Delta _r}H_{298}^0\) = a.Eb (A) + b.Eb (B) – m.Eb(M) – n.Eb(N)
– Trong đó, Eb (A), Eb (B), Eb (M), Eb (N) lần lượt là tổng năng lượng liên kết của tất cả các liên kết trong phân tử A, B, M và N.
Ví dụ: Cho phản ứng:
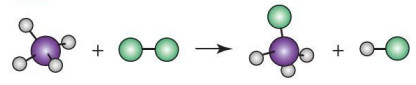
CH4(g) + Cl2 (g) → CH3Cl (g) + HCl (g)
– Biến thiên enthalpy chuẩn của phản ứng trên được tính theo năng lượng liên kết như sau:
\({\Delta _r}H_{298}^0\) = 1.Eb (CH4) + 1.Eb (Cl2) – 1.Eb(CH3Cl) – 1.Eb(HCl)
\({\Delta _r}H_{298}^0\) = 1.4EC-H + 1.ECl-Cl – 1.(3EC-H + ECl-Cl) – 1.EH-Cl = 1.4.414 +1.243 – 1.(3.414 + 339) – 1.431 = -113 kJ.
– Phản ứng có \({\Delta _r}H_{298}^0\) âm nên phản ứng toả nhiệt và diễn ra thuận lợi. Trong thực tế, chỉ cần được chiếu ánh sáng mặt | trời là phản ứng đã diễn ra.
|
– Các phản ứng toả nhiệt (\({\Delta _r}H_{298}^0\) < 0) thường diễn ra thuận lợi hơn các phản ứng thu nhiệt (\({\Delta _r}H_{298}^0\) > 0). – Có hai cách tính \({\Delta _r}H_{298}^0\) là tính theo enthalpy tạo thành và tính theo năng lượng liên kết. |
|---|