1.1. Liên kết cộng hóa trị
– Ngoài cách nhường và nhận electron để hình thành hợp chất ion, quy tắc octet có thể đạt được bằng cách góp chung electron. Electron chung là electron được coi như thuộc về đồng thời hai nguyên tử tham gia liên kết. Liên kết do sự dùng chung cặp electron là loại liên kết rất phổ biển, thường gặp giữa phi kim với phi kim.
– Liên kết cộng hoá trị là liên kết được hình thành bởi một hay nhiều cặp electron chung giữa hai nguyên tử.
Ví dụ 1
– Nguyên tử hydrogen (H) có cấu hình electron 1s1, chlorine (Cl) có cấu hình electron [Ne]3s23p5. Để đạt được cấu hình của khí hiếm gần nhất, mỗi nguyên tử này đều cần thêm 1 electron. Vì vậy, mỗi nguyên tử H và Cl cùng góp 1 electron để tạo nên 1 cặp electron chung cho cả hai nguyên tử (Hình 11.2).
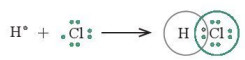
Hình 11.2. Sự hình thành cặp electron chung của HCl
– Như vậy, liên kết giữa nguyên tử H và Cl được tạo nên bởi 1 cặp electron chung. Công thức 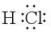 gọi là công thức electron của HCl.
gọi là công thức electron của HCl.
– Nếu giữa hai nguyên tử chỉ có một cặp electron chung thì cặp electron này được biểu diễn bằng một nối đơn (-) và gọi là liên kết đơn. Khi đó, HCl được biểu diễn như sau: 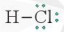
– Công thức trên được gọi là công thức Lewis của HCl.
– Như vậy, công thức Levis là công thức biểu diễn cấu tạo phân tử qua các liên kết (cặp electron chung và các electron hoá trị riêng.
– Hợp chất HCl được tạo nên chi bởi liên kết cộng hoá trị nên thuộc loại hợp chất cộng hoá trị.
Ví dụ 2
– Hình 11.3 mô tả các cặp electron chung trong phân tử CO2. Công thức cấu tạo của CO2 là O=C=O
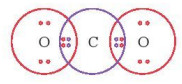
Hình 11.3. Các cặp electron chung và electron hoá trị riêng trong phân tử CO2
– Nếu giữa hai nguyên tử có hai cặp electron chung thì hai cặp electron này được biểu diễn bằng một nối đôi (=) và gọi là liên kết đôi.
Ví dụ 3
– Hình 11.4 mô tả các electron chung của hai nguyên tử trong phân tử N2.
– Công thức cấu tạo của N2 là N\( \equiv \)N.
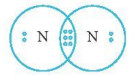
Hình 11.4. Các cặp electron chung và electron hoá trị riêng trong phân tử N2
– Nếu giữa hai nguyên tử có ba cặp electron chung thì ba cặp electron này được biểu diễn bằng một nối ba (\( \equiv \)) và gọi là liên kết ba.
Ví dụ 4
– Phân tử ammonia kết hợp với ion H+ tạo ra cation ammonium (NH4+) (Hình 11.5).
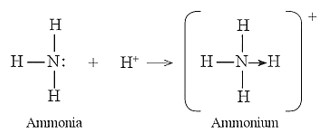
Hình 11.5. Sự hình thành liên kết cho nhận trong NH4+
– Trên nguyên tử N còn 1 cặp electron hoá trị riêng, khi hình thành NH4+, cặp electron này trở thành cặp electron chung cho N và H, cả N và các nguyên tử H đều thoả mãn quy tắc octet. Như vậy, liên kết đơn giữa nguyên tử N trong NH3 với H+ được tạo thành bởi một cặp electron góp chung của nguyên tử N.
– Để chỉ rõ sự khác biệt về nguồn gốc cặp electron chung, liên kết tạo bởi cặp electron của N và ion H+ được kí hiệu là mũi tên (\( \to \)) xuất phát từ N. Loại liên kết này được gọi là liên kết cho nhận.
– Liên kết cho nhận là liên kết mà cặp electron chung được đóng góp từ một nguyên tử.
|
– Liên kết cộng hoá trị được hình thành bởi một hay nhiều cặp electron chung giữa hai nguyên tử. – Công thức Lewis là công thức biểu diễn cấu tạo phân tử qua các liên kết và các electron riêng. – Liên kết cho nhận là liên kết mà cặp electron chung được đóng góp từ một nguyên tử. |
|---|
1.2. Phân loại liên kết theo độ âm điện
– Dựa vào hiệu độ âm điện (\(\Delta \chi \), đọc là đen-ta khi) giữa hai nguyên tử A và B có thể cho biết kiểu liên kết giữa hai nguyên tử đó.
\(\Delta \chi \) = \({\chi _B}\) – \({\chi _A}\), trong đó \({\chi _B}\) > \({\chi _A}\)
– Quy tắc phân loại liên kết theo độ âm điện
\(0 \le \Delta \chi < 0,4\): Liên kết cộng hóa trị không cực
\(0,4 \le \Delta \chi < 1,7\): Liên kết cộng hóa trị có cực
\(\Delta \chi \ge 1,7\): Liên kết ion
– Có một số trường hợp ngoại lệ không tuân theo quy tắc trên như hợp chất cộng hoá trị HF, hợp chất ion MnI2,…
| Dựa theo độ âm điện, có thể dự đoán liên kết thuộc loại ion, cộng hoá trị không cực hay có cực. |
|---|
1.3. Liên kết Sigma (\(\sigma \)) và liên kết Pi (\(\pi \))
– Liên kết cộng hoá trị được hình thành từ cặp electron chung. Để tạo nên một cặp electron chung, hai AO chứa electron độc thân (hoặc giữa 1 AO trống và 1 AO bão hoà electron) cần xen phủ với nhau. Các ví dụ dưới đây chỉ xét đến sự xen phủ của AO s và AOp.
– Có hai kiểu xen phủ AO là xen phủ trục và xen phủ bên.
a. Xen phủ trục
– Xen phủ trục là xen phủ giữa hai AO dọc theo trục nối (trục z) hai nguyên tử. Có ba khả năng xen phủ trục:
+ Xen phủ giữa AO s với AO s

+ Xen phủ giữa AO s với AO p

+ Xen phủ giữa AO p với AO p
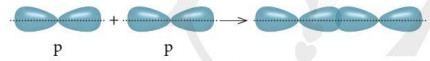
– Liên kết được tạo nên từ xen phủ trục của hai AO gọi là liên kết sigma
b. Xen phủ bên
– Xen phủ bên là sự xen phi xảy ra giữa hai AO p song song với nhau.
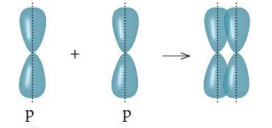
– Liên kết được tạo nên từ xen phủ bên của hai AO gọi là liên kết pi (\(\pi \)).
– Liên kết đơn còn gọi là liên kết \(\sigma \), liên kết đôi gồm một liên kết \(\sigma \) và một liên kết \(\pi \), liên kết ba gồm một liên kết \(\sigma \) và hai liên kết \(\pi \).
|
– Liên kết được tạo nên từ xen phủ trục của hai AO gọi là liên kết sigma \(\sigma \). – Liên kết được tạo nên từ xen phủ bên của hai AO gọi là liên kết pi (\(\pi \)). Liên kết \(\sigma \) bền hơn liên kết \(\pi \). |
|---|
1.4. Năng lượng của liên kết cộng hóa trị
– Khi các nguyên tử liên kết với nhau sẽ tạo thành một hệ bền vững hơn, quá trình này giải phóng năng lượng. Do vậy, để phá vỡ liên kết giữa các nguyên tử thì phải cung cấp năng lượng.
Ví dụ:
– Để phá vỡ liên kết H-H trong 1 mol khí H2 ở 25°C và 1 bar cần năng lượng là 436 kJ.
– Năng lượng liên kết là năng lượng cần thiết để phá vỡ một liên kết xác định trong phân tử ở thể khi, tại 25°C và 1 bar. Đơn vị của năng lượng liên kết thường là kJ mol-1. Năng lượng liên kết càng lớn, liên kết đó càng bền.
Ví dụ: Năng lượng liên kết của H-H là 436 kJ mol-1, của H-I là 297 kJ mol-1. Như vậy, liên kết H-H bền hơn liên kết H-I. Có thể thấy điều này qua nhiệt độ bắt đầu xảy ra sự phân huỷ tạo thành các nguyên tử từ phân tử: của H2 là khoảng 2000°C, trong khi của HI chỉ khoảng 200°C.
| Năng lượng liên kết là năng lượng cần thiết để phá vỡ một liên kết xác định trong phân tử ở thể khí, tại 25°C và 1 bar. Đơn vị của năng lượng liên kết thường là k mol-1. Năng lượng liên kết càng lớn, liên kết càng bền. |
|---|