1.1. Quy tắc Octet
– Trong phản ứng hoá học, các nguyên tử có xu hướng hình thành lớp vỏ bên vũng như của khí hiểm.
– Quy tắc này lần đầu được đưa ra bởi Lewis (Li-uýt, 1875 – 1946, nhà hoá học, vật lí người Mỹ) để lí giải xu hướng các nguyên tử trở nên bền vững hơn trong phản ứng hoá học.
– Các nguyên tử khí hiểm bền vững hơn rất nhiều so với các nguyên tử nguyên tố khác trong cùng chu kì nên rất khó tham gia các phản ứng hoá học. Điều này là do chúng có lớp electron ngoài cùng đã bão hoà với 8 electron (ngoại lệ là He với lớp electron ngoài cùng bão hoà 2 electron).
– Các nguyên tử liên kết với nhau theo xu hướng chung là tạo ra lớp electron ngoài cũng như của khí hiếm để mỗi nguyên tử đó trở nên bền vững hơn.
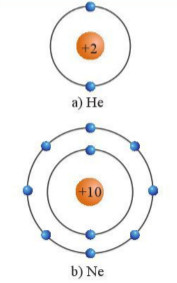
Hình 9.1. Mô hình cấu tạo của Helium và Neon
1.2. Vận dụng quy tắc Octet trong quá trình hình thành liên kết hóa học của các nguyên tố nhóm A
Trong quá trình hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt được cấu hình bền vững như của khí hiểm với 8 electron lớp ngoài cùng (hoặc 2 electron ở lớp ngoài cũng như của helium).
Ví dụ 1
– Nguyên tử chlorine với cấu hình electron là [Ne]3s23p5 có 7 electron ở lớp ngoài cùng.
– Vậy xu hướng cơ bản của nguyên tử chlorine khi hình thành liên kết hoá học là nhận thêm 1 electron để đạt được 8 electron ở lớp ngoài cũng như của khí hiểm An (thay vì Cl phải nhường đi 7 electron để có lớp electron ngoài cùng là 2s22p6 – khó khăn hơn rất nhiều) (Hình 9.2).
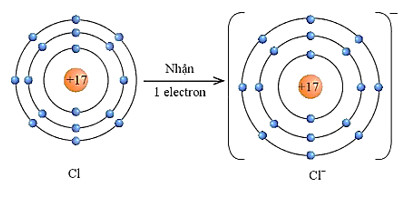
Hình 9.2. Sơ đồ nguyên tử Cl nhận thêm 1 electron vào lớp ngoài cùng
– Các phi kim với 5, 6 hoặc 7 electron ở lớp ngoài cùng có xu hướng nhận thêm electron để đạt 8 electron ở lớp ngoài cùng. Trong cùng chu kì, các nguyên tử có lớp ngoài cùng với 7 electron (các halogen) dễ nhận thêm electron hơn nên có tính phi kim mạnh nhất.
Ví dụ 2
– Nguyên tử sodium với cấu hình electron là [Ne]3s1 có 1 electron ở lớp vỏ ngoài cùng.
– Vậy xu hướng cơ bản của nguyên tử sodium khi hình thành liên kết hoá học là nhường đi 1 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài cũng như của khi hiểm Ne (thay vì sodium phải nhận thêm 7 electron để có lớp electron ngoài cùng là 3s23p6 – khó khăn hơn rất nhiều) (Hình 9.3).
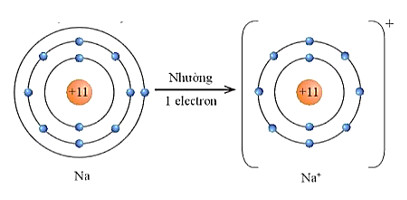
Hình 9.3. Sơ đồ nguyên tử Na nhường đi 1 electron ở lớp ngoài cùng
– Nói chung, các kim loại có 1, 2 hoặc 3 electron ở lớp ngoài cùng có xu hướng nhường bớt toàn bộ các electron này để tạo thành ion dương tương ứng có 8 electron ở lớp ngoài củng. Trong cùng chu kì, nguyên tử có 1 electron ở lớp ngoài cùng các kim loại kiềm) dễ nhường electron hơn nên có tính kim loại mạnh nhất.
– Ngoài cách các nguyên tử nhường và nhận electron để hình thành liên kết ion, quy tắc octet có thể đạt được bằng cách góp chung electron.
Ví dụ 3
– Phân tử H2 được hình thành từ hai nguyên tử H bởi sự góp chung electron (Hình 9.4).
– Sau khi hình thành liên kết, xung quanh mối nguyên tử H có 1 đôi electron chung, giống lớp vỏ bền vững của khỉ hiểm He.
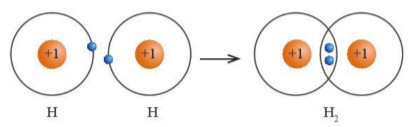
Hình 9.4. Sự góp chung electron trong phân tử H2
Trong quá trình hình thành liên kết hoá học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt được cấu hình bền vững như của khí hiếm với 8 electron ở lớp ngoài cùng (hoặc 2 electron ở lớp ngoài cũng như của helium).