1.1. Mô hình nguyên tử
a. Mô hình Rutherford – Bohr
– Mô hình nguyên tử theo Rutherford-Bohr (Rơ-do-pho-Bo) có các nội dung chính sau:
+ Khối lượng nguyên tử tập trung chủ yếu ở hạt nhân.
+ Electron quay xung quanh hạt nhân theo những quỹ đạo giống như các hành tinh quay xung quanh Mặt Trời.
Ví dụ: Electron duy nhất của nguyên tử hydrogen quay trên quỹ đạo có bán kính cố định = 0,53 \(\mathop A\limits^0 \). Khi quay trên quỹ đạo này, electron có năng lượng không thay đổi.
+ Năng lượng của electron phụ thuộc vào khoảng cách từ electron đó tới hạt nhân nguyên tử. Electron ở càng xa hạt nhân thì có năng lượng càng cao.
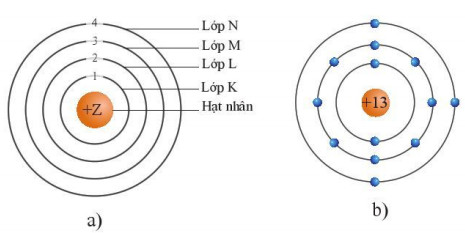
Hình 4.2. Mô hình nguyên tử theo Rutherford – Bohr (a) và cấu trúc nguyên tử aluminium theo mô hình này (b)
– Theo chiều từ hạt nhân ra ngoài lớp vỏ, các electron được sắp xếp vào các lớp electron. Kí hiệu của mỗi lớp như sau:
+ Lớp thứ nhất gọi là lớp K.
+ Lớp thứ hai gọi là lớp L.
+ Lớp thứ ba gọi là lớp M.
+ Lớp thứ tư gọi là lớp N.
– Các electron được phân bổ vào lớp gần hạt nhân trước. Số electron tối đa trong mỗi lớp là 2n2, với n là số thứ tự lớp electron (n<4).
– Dựa theo mô hình nguyên tử của Rutherford – Bohr, hãy vẽ mô hình nguyên tử các nguyên tố có 2 từ 1 đến 11.
b. Mô hình hiện đại về nguyên tử
– Sự khác biệt cơ bản của mô hình hiện đại với mô hình nguyên tử của Rutherford-Bohr là các electron chuyển động xung quanh hạt nhân không theo những quỹ đạo cố định. Theo mô hình hiện đại về nguyên tử, electron chuyển động rất nhanh trong cả khu vực không gian xung quanh hạt nhân với xác suất tìm thấy khác nhau, sự chuyển động này tạo nên một hình ảnh giống như một đám mây electron.

Hình 4.3. Minh hoạ đám mây electron của nguyên tử hydrogen
– Xác suất tìm thấy electron trong đám mây electron minh hoạ ở Hình 4.3 là khoảng 90%, nghĩa là electron dù chuyển động khắp nơi trong không gian xung quanh hạt nhân nguyên tử, nhưng tập trung phần lớn ở khu vực này.
|
– Sự khác biệt cơ bản giữa mô hình Rutherford – Bohr và mô hình hiện đại về nguyên tử là: Electron chuyển động theo quỹ đạo giống như các hành tinh quay xung quanh Mặt Trời (mô hình Rutherford – Bohr) và electron chuyển động không theo quỹ đạo Cố định (mô hình hiện đại). – Khái niệm orbital nguyên tử (AO) xuất phát từ mô hình hiện đại về nguyên tử: Orbital nguyên tử là khu vực không gian xung quanh hạt nhân nguyên tử mà xác suất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%). |
|---|
1.2. Orbital nguyên tử
a. Khái niệm
– Orbital nguyên tử (kí hiệu là AO) là khu vực không gian xung quanh hạt nhân nguyên tử mà xác suất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%).
– Orbital nguyên tử kí hiệu là AO (viết tắt của cụm từ tiếng Anh: Atomic Orbital)
Ví dụ: Khu vực không gian trong khối cầu xung quanh hạt nhân hydrogen (Hình 4.3) mà xác suất tìm thấy electron tại đó là khoảng 90% chính là orbital nguyên tử của hydrogen.
– Orbital nguyên tử có một số hình dạng khác nhau.
Ví dụ: AO hình cầu, còn gọi là AO S, AO hình số tám nổi, còn gọi là AO p (tuỳ theo vị trí của AO p trên hệ trục toạ độ Descartes (Đề-các), sẽ gọi là AO px, py, và pz)
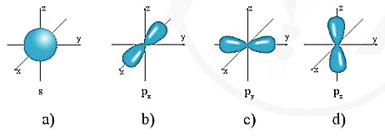
Hình 4.4. Hình dạng của AO s(a) và AO p (b, c, d)
– Các AO p trong cùng một lớp electron có kích thước và hình dạng tương tự nhau nhưng khác nhau về định hướng trong không gian.
– Ngoài các AO hay gặp là s và p, còn có các AO khác như d, f có hình dạng phức tạp hơn.
b. Số lượng electron trong một AO
– Electron chuyển động trong AO s gọi là elections, electron chuyển động trong AO p gọi là electron p,…
– Một AO chỉ chứa tối đa 2 electron, 2 electron này được gọi là cặp electron ghép đôi. Nếu AO chỉ có 1 electron, electron đó được gọi là electron độc thân. Nếu AO không chứa electron nào thì gọi là AO trống.
|
– Các AO S, p,… có hình dạng khác nhau. – Mỗi AO chỉ chứa tối đa 2 electron. |
|---|