1.1. Nguyên tử Halogen
– Nhóm halogen gồm: Flo (F), Clo (Cl), Brom (Br), Iot (I), Atatin (At) (Atatin không gặp trong tự nhiên, nó được điều chế nhân tạo trong các lò phản ứng hạt nhân nên được xem xét chủ yếu trong nhóm các nguyên tố phóng xạ).
– Các nguyên tố halogen thuộc nhóm VIIA. Chúng đứng gần cuối chu kì, ngay trước các nguyên tố khí hiếm.
– Nguyên tử các nguyên tố halogen đều có 7e lớp ngoài cùng (ns2 np5)
– Ở trạng thái tự do, 2 nguyên tử halogen góp chung 1e với nhau tạo 1 liên kết cộng hóa trị không cực.
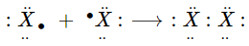
(X là kí hiệu chỉ các nguyên tố halogen)
⟶ Công thức cấu tạo: X−X
⟶ Công thức phân tử: X2
– Liên kết trong phân tử X2 không bền lắm, dễ bị tách thành 2 nguyên tử X.
– Trong phản ứng hóa học, các nguyên tử X dễ thu thêm 1e.
⟹ Tính chất hóa học cơ bản của các halogen là tính oxi hóa mạnh.
1.2. Đơn chất Halogen
a. Sự biến đổi tính chất vật lí của các đơn chất
Từ F đến I ta thấy:
– Trạng thái tập hợp: khí ⟶ lỏng ⟶ rắn.
– Màu sắc: đậm dần.
– Nhiệt độ nóng chảy, nhiệt độ sôi tăng dẫn
b. Sự biến đổi độ âm điện
– Độ âm điện tương đối lớn.
– Giảm dần từ F đến I.
– Trong hợp chất:
+ F có độ âm điện lớn nhất nên chỉ có số oxi hóa −1.
+ Các nguyên tố halogen khác, ngoài số oxi hóa −1 còn có các số oxi hóa +1, +3, +5, +7.
c. Sự biến đổi tính chất hóa học của các đơn chất
– Các đơn chất halogen giống nhau về tính chất hóa học cũng như thành phần và tính chất của các hợp chất do chúng tạo thành (Do lớp e ngoài cùng có cấu hình tương tự nhau ( ns2np5) .
– Halogen là những phi kim điển hình. Tính oxi hóa giảm dần từ Flo đến Iot.
– Các đơn chất halogen oxi hóa được:
+ Hầu hết các kim loại ⟶ muối halogenua.
+ H2 ⟶ hợp chất khí không màu hiđro halogenua (khí này tan trong nước tạo dung dịch axit halogenhiđric).
1.3. Hydrogen Halide
– HCl, HBr, HI tác dụng với kim loại tạo muối và khí H2 : 2xHX + M → MClx + xH2
– HCl, HBr, HI không tác dụng được với Cu, Ag, Au, Pt.
– HCl, HBr, HI khi tác dụng với Fe và Cr chỉ tạo thành Fe2+ và Cr2+.
→ Tính acid tăng dần từ HF (acid yếu) đến HI (acid rất mạnh)
1.4. Muối Halide
– Hầu hết các muối halide đều dễ tan trong nước, trừ một số muối không tan như silver chloride, silver bromide, silver iodide và một số muối ít tan như lead chroride, lead bromide.
– lon halide, muối halide: Tính khử tăng dần từ fluoride đến iodide.