1.1. Trạng thái tự nhiên
– Nhóm VIIA trong bảng tuần hoàn các nguyên tố hoá học còn gọi là nhóm halogen, gồm sáu nguyên tố: fluorine (F), chlorine (Cl), bromine (Br), iodine (I), astatine (At) và tennessine (Ts). Bốn nguyên tố F, G, Br và T tồn tại trong tự nhiên, còn At và Ts là các nguyên tố phóng xạ.
– Trong tự nhiên, halogen chỉ tồn tại ở dạng hợp chất, phần lớn ở dạng muối halide, phổ biến nhu calcium fluoride, sodium chloride.
Bảng 21.1. Nồng độ các ion halide trong nước biển
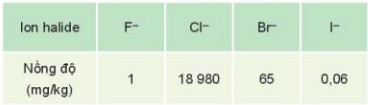
– Trong cơ thể người, nguyên tố chlorine có trong máu và dịch vị dạ dày (ở dạng ion Cl–), nguyên tố iodine có tuyến giáp (ở dạng hợp chất hữu cơ).

Hình 21.1. Rong biển chứa nguyên tố iodine
| Các nguyên tố halogen tồn tại trong tự nhiên ở dạng hợp chất, phổ biến là muối của fluorine và chlorine. |
|---|
1.2. Cấu tạo nguyên tử, phân tử
– Các nguyên tử halogen có 7 electron ở lớp ngoài cùng, dễ nhận thêm 1 electron để đạt được cấu hình electron bền của khí hiếm gần nhất:
ns2np5 + 1e → ns2np6
– Do vậy, số oxi hoá đặc trưng của các halogen trong hợp chất là -1.
– Tuy nhiên, khi liên kết với các nguyên tố có độ âm điện lớn, các halogen có thể có các số oxi hoá dương: +1, +3, +5, +7 (trừ fluorine có độ âm điện lớn nhất, nên fluorine luôn có số oxi hoá bằng -1 trong mọi hợp chất).
1.3. Tính chất vật lí
– Trạng thái tồn tại, màu sắc, nhiệt độ nóng chảy (tnc), nhiệt độ sôi (ts) của halogen được trình bày ở Bảng 21.2:
Bảng 21.2. Một số tính chất vật lí của đơn chất halogen
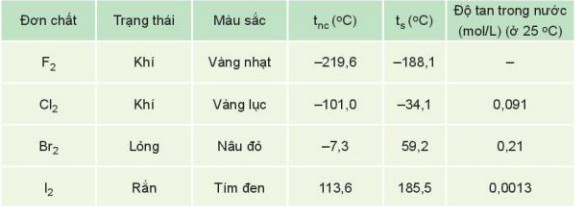
– Nhiệt độ nóng chảy, nhiệt độ sôi tăng từ F2 đến I2 do:
+ Tương tác van der Waals giữa các phân tử tăng.
+ Khối lượng phân tử tăng.
– Ở điều kiện thường, các halogen ít tan trong nước nhưng tan nhiều trong dung môi hữu cơ như alcohol, benzene. Trong y học, dung dịch iodine loãng trong ethanol được dùng làm thuốc sát trùng.
– Bromine gây bỏng sau khi tiếp xúc với da. Hít thở không khí có chứa halogen với nồng độ vượt ngưỡng cho phép làm tổn hại niêm mạc tế bào đường hô hấp, gây co thắt phế quản, khó thở.
1.4. Tính chất hóa học
– Halogen là các phi kim điển hình, có tính oxi hoá mạnh, tính oxi hoá giảm dần từ fluorine đến iodine.
a. Tác dụng với kim loại
– Các halogen phản ứng trực tiếp với nhiều kim loại, tạo muối halide.
– Sodium nóng chảy sẽ cháy với ngọn lửa sáng chói trong khi chlorine, tạo thành sodium chloride: 2Na + Cl2 → 2NaCl
– Dây sắt (iron) nung đỏ sẽ bốc cháy trong khi chlorine, tạo thành khói màu nâu đỏ là iron(III) chloride (Hình 21.5): 2Fe + 3Cl2 → 2FeCl3

Hình 2.5. Chlorine tác dụng với dây sắt (iron) nhiệt độ cao
b. Tác dụng với hydrogen
– Các halogen phản ứng với hydrogen, tạo thành hydrogen halide.
Bảng 21.3. Một số đặc điểm của phản ứng giữa halogen và hydrogen

– Mức độ phản ứng của các halogen với hydrogen giảm dần khi đi từ fluorine đến iodine, phù hợp với tính oxi hoá của các halogen giảm dần từ F2 đến I2
c. Tác dụng với nước
– Khi tan vào nước, một phần Cu tác dụng với nước tạo thành HCl (hydrochloric acid) và HClO (hypochlorous acid): Cl2 + H2O ⇔ HCl + HClO
– Hypochlorous acid có tính oxi hoá mạnh nên chlorine trong nước có khả năng diệt khuẩn, tẩy màu và được ứng dụng trong khử trùng nước sinh hoạt.
d. Tác dụng với dung dịch kiềm
– Chlorine phản ứng với dung dịch kiềm ở điều kiện thường, tạo thành nước Javel (Gia-ven): Cl2 + 2NaOH → NaCl + NaClO + H2O
– Nước Javel (chứa NaClO (sodium hypochlorite), NaCl và một phần NaOH dư) được dùng làm chất tẩy rửa, khử trùng.
– Khi đun nóng, Cl2 phản ứng với dung dịch kiềm tạo thành muối chlorate: 3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
– Potassium chlorate là chất oxi hoá mạnh, được sử dụng chế tạo thuốc nồ, hỗn hợp đầu que diêm,…
e. Tác dụng với dung dịch halide
– Chlorine có thể oxi hoá ion Br– trong dung dịch muối bromide và ion I– trong dung dịch muối iodide, bromine có thể oxi hoá ion I– trong dung dịch muối iodide.
Cl + 2NaBr– → NaCl + Br2
Br2 + 2Nal → 2NaBr + I2
– Trong công nghiệp, phản ứng giữa chlorine và ion bromide được ứng dụng để điều chế bromine từ nước biển.
|
Các đơn chất halogen từ fluorine đến iodine: – Nhiệt độ nóng chảy tăng dần, nhiệt độ sôi tăng dần. – Là phi kim điển hình, tính oxi hoá giảm dần. |
|---|
1.5. Điều chế Chlorine
– Năm 1774, C. W Scheele (Se-lơ), nhà hoá học người Thụy Điển, điều chế được chlorine khi cho quặng pyrolusite (MnO2) tác dụng với hydrochloric acid đặc: MnO2 + 4HCl (đặc) → MnCl2 + Cl2 + 2H2O
– Ngày nay, phản ứng trên vẫn được dùng khi cần điều chế khi Cl2 trong phòng thí nghiệm. Ngoài ra, còn có thể thay MnO2 bằng KMnO4 rắn để điều chế khí C: 2KMnO4 + 16HCl (đặc) → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
– Trong công nghiệp, chlorine được sản xuất ở nhiệt độ thường bằng cách điện phân dung dịch muối ăn bão hoà, có màng ngăn giữa các điện cực: 2NaCl + 2H2O → 2NaOH + H2 + Cl2