1.1. Thành phần của các Oxide và Hydroxide
– Hoá trị cao nhất của các nguyên tố nhóm A trong hợp chất với oxygen tăng từ I đến VII khi đi từ trái qua phải trong một chu kì (trừ chu kì 1 và nguyên tố fluorine ở chu kì 2), do đó thành phần của các oxide và hydroxide có sự lặp lại theo chu kì.
Bảng 7.1. Công thức oxide, hydroxide ủng với hoá trị cao nhất của các nguyên tố thuộc chu kì 2, 3
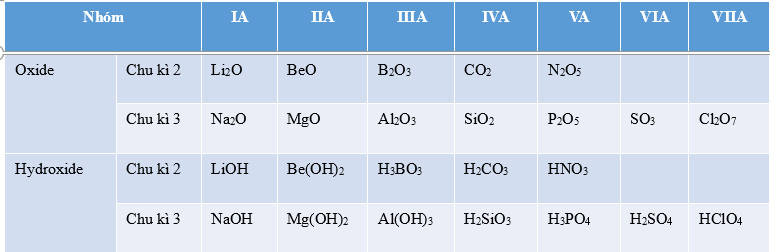
|
– Hóa trị cao nhất của với oxy của nguyên tố nhóm A tăng từ I đến VII từ trái qua phải trong một chu kì. – Thành phần của các oxide và hydroxide có sự lặp lại theo chu kì. |
|---|
1.2. Tính chất của Oxide và Hydroxide
– Các oxide khi tác dụng với nước tạo thành hydroxide có tính base hoặc acid. Nói chung. hydroxide của các nguyên tố nhóm là thể hiện tinh base mạnh, hydroxide ứng với hoá trị cao nhất của các nguyên tố nhóm VIIA (trừ fluorine) thể hiện tính acid mạnh.
Bảng 7.2. Tính acid – base của oxide và hydroxide ứng với hoá trị cao nhất
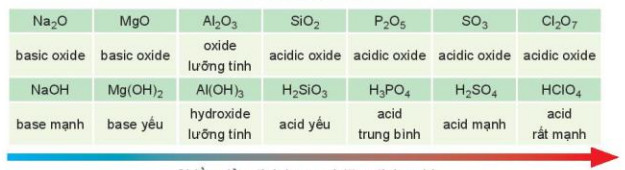
Chiều giảm tỉnh base và tăng tính acid
| Trong một chu kì: theo chiều tăng dần của điện tích hạt nhân, tỉnh base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần. |
|---|