1.1. Cấu hình electron nguyên tử của các nguyên tố nhóm A
Bảng 6.1. Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A
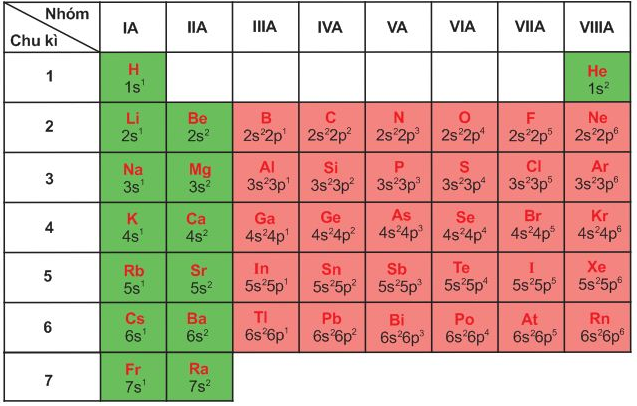
– Nhóm A gồm các nguyên tố s và p. Nguyên tử của các nguyên tố cùng một nhóm A có số electron lớp ngoài cùng (electron hoá trị) bằng nhau (trừ He trong nhóm VIIIA). Sự giống nhau về số electron hoá trị dẫn đến sự tương tự nhau về tính chất hoá học của các nguyên tố trong cùng nhóm A.
– Sau mỗi chu kì, cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A được lặp đi lặp lại một cách tuần hoàn. Sự biến đổi tuần hoàn cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần là nguyên nhân của sự biến đổi tuần hoàn về tính chất của các nguyên tố.
1.2. Bán kính nguyên tử
– Một cách gần đúng, bán kinh nguyên tử được xác định bằng nửa khoảng cách trung bình giữa hai hạt nhân nguyên tử gần nhau nhất trong chất rắn đon chất hoặc trong phân từ hai nguyên tử giống nhau.
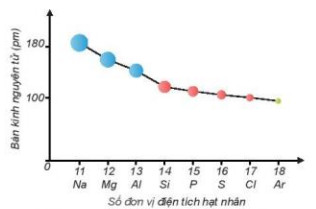
Hình 6.1. Sự giảm bán kính nguyên tử của các nguyên tố trong chu kì 3
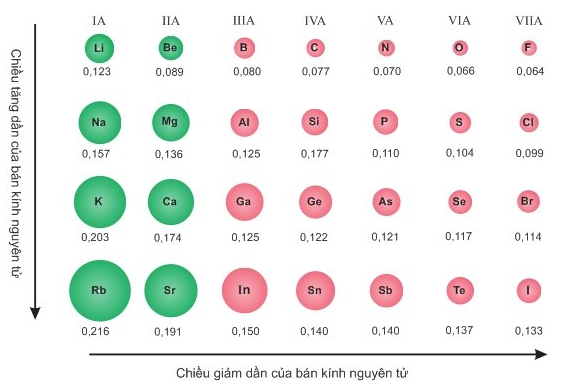
Hình 6.2. Giá trị bán kính nguyên tử (pm)
– Bán kinh nguyên tử phụ thuộc vào lực hút giữa hạt nhân với các electron lớp ngoài cùng.
– Bán kinh giảm là do lực hút tăng và ngược lại, bán kinh tăng là do lực hút giảm.
– Xu hướng biến đổi bán kinh nguyên tử:
+ Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dân của điện tích hạt nhân.
+ Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân.
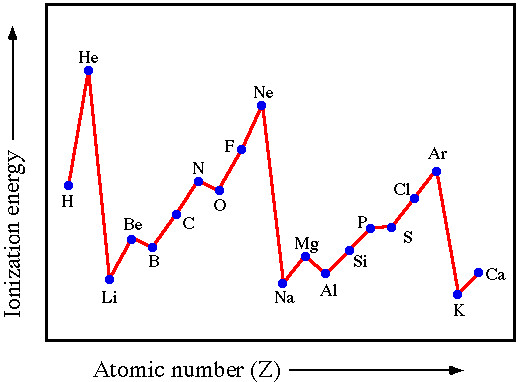
Hình 6.3. Sự biến đổi năng lượng ion hoá thứ nhất của các nguyên tố chu kì 2 và 3
– Năng lượng ion hoá thứ nhất của nguyên tử là năng lượng tối thiểu cần thiết để tách electron thử nhất ra khỏi nguyên tử ở thể khi, ở trạng thái cơ bản: X(g) → X*(g) + e
– Năng lượng ion hoá thứ nhất kí hiệu là I1, đơn vị là kJ/mol.
Ví dụ:
– Để tách một mol electron ra khỏi mộ mol nguyên tử hydrogen theo quá trình: H(g) → H+ (g) + e phải tiêu tốn một năng lượng là 1312 kJ, do đó I1 = 1312 kJ/mol.
– Trong một chu kì, năng lượng ion hoá thứ nhất có xu hướng tăng theo chiều tăng dần của điện tích hạt nhân.
– Trong một nhóm A, năng lượng ion hoả thử nhất có xu hướng giảm theo chiều tăng dần của điện tích hạt nhân.
|
Theo chiều tăng dần của điện tích hạt nhân nguyên tử – Trong một chu kì: Bán kính nguyên tử giảm dần – Trong một nhóm A: Bán kính nguyên tử tăng dần |
|---|
1.3. Độ âm điện
– Độ âm điện của nguyên tử (\(\chi \)) là đại lượng đặc trưng cho khả năng hút electron của nguyên tử một nguyên tố hoá học khi tạo thành liên kết hoá học.
– Khi tham gia liên kết hoá học, nguyên tử Có độ âm điện nhỏ dễ nhường electron, nguyên tử có độ âm điện lớn dễ nhận electron.
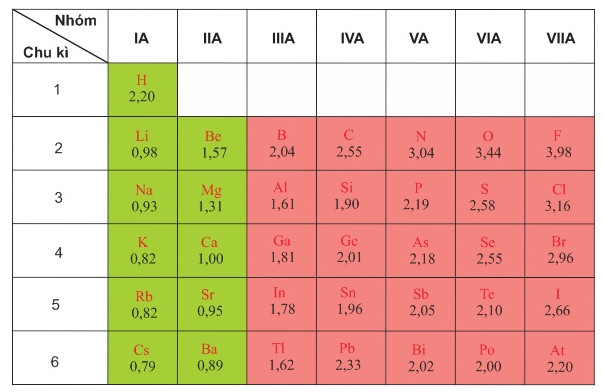
Dưới đây là bảng giá trị độ âm điện do nhà hoá học L. C. Pauling (Pau-linh) thiết lập vào năm 1932.
Bảng 6.2. Giá trị độ âm điện tương đối theo L. C. Pauling
– Xu hướng biến đổi độ âm điện theo chiều tăng dần của điện tích hạt nhân:
– Độ âm điện tăng từ trái qua phải trong một chu ki.
– Trong một chu kì, khi số electron lớp ngoài cũng tăng, điện tích hạt nhân tăng thị lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng nên độ âm điện tăng.
– Độ âm điện giảm từ trên xuống dưới trong một nhóm A.
– Trong một nhómA, khi số lớp electron tăng, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm nên độ âm điện giảm.
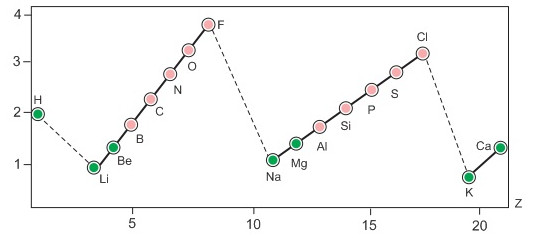
Hình 6.4. Sự biến đổi độ âm điện theo chu kì và nhóm
|
Theo chiều tăng dần của điện tích hạt nhân nguyên tử – Trong một chu kì: Độ âm điện tăng dần – Trong một nhóm A: Độ âm điện giảm dần |
|---|
1.4. Tính kim loại và tính phi kim
a. Khái niệm
– Tính kim loại là tính chất của một nguyên tố mà nguyên tử của nó dễ nhường electron. để trở thành ion dương. Nguyên tử của nguyên tố nào càng dễ nhường electron để trở thành ion dương, tính kim loại của nguyên tố đó càng mạnh
– Tính phi kim là tính chất của một nguyên tố mà nguyên tử của nó dễ nhận electron để trở thành ion âm, Nguyên tử của nguyên tố nào càng dễ nhận electron để trở thành con âm, tính phi kim của nguyên tố đó càng mạnh.
b. Sự biến đổi tính kim loại, tính phi kim
– Xu hướng biến đổi tính kim loại và tính phi kim:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần. Do bản kinh nguyên tử giảm, lực hút giữa hạt nhân với các electron lớp ngoài cùng tang, dẫn đến khả năng nhường electron giảm nên tính kim loại giảm, khả năng nhận electron tăng nên tính phi kim tăng.
+ Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tỉnh kim loại tăng dần và tính phi kim giảm dần. Tuy điện tích hạt nhân tăng dần, nhưng bản kinh nguyên tử tăng nhanh hơn, lực hút giữa hạt nhân với các electron lớp ngoài cũng giảm dẫn đến khả năng nhường electron tăng nên tính kim loại tầng, khả năng nhận electron giảm nên tính phi kim giảm.
|
Theo chiều tăng dần của điện tích hạt nhân nguyên tử – Trong một chu kì: + Tính kim loại giảm dần và tính phi kim tăng dần. + Số electron hoá trị của nguyên tử các nguyên tố nhóm A tăng lần lượt từ 1 đến 8. – Trong một nhóm A: Tính kim loại tăng dần và tính phi kim giảm dần. |
|---|