1.1. Các loại hạt cấu tạo nên nguyên tử
– Năm 1897, J, J, Thomson (Tôm-xơn, người Anh) thực hiện thí nghiệm phóng điện qua không khí loăng đã phát hiện ra chùm tia phát ra từ cực ấm và bị hút lệch về phía cực dương của điện trường, chứng tỏ chúng mang điện tích âm (xem hình 1.1). Đó chính là chùm các hạt electron. Electron là một thành phần của nguyên tử.
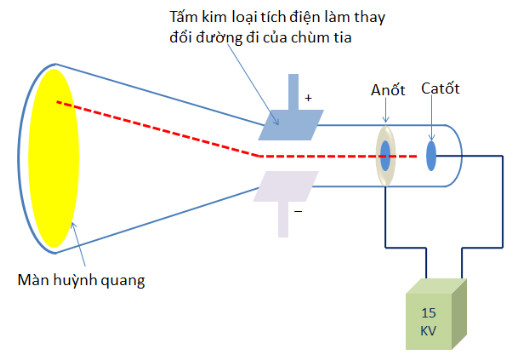
Hình 1.1. Thí nghiệm phát hiện hạt electron
– Năm 1911E Rutherford (Ro-do-pho, người Niu Di-lân) thực hiện thí nghiệm bắn phá lá vàng rất mỏng bằng chùm hạt \(\alpha *\)) (alpha) (Hình 1.2). Ông sử dụng màn huỳnh quang bao quanh lá vàng để quan sát vị trí va chạm của hạt \(\alpha \). Kết quả thí nghiệm cho thấy hầu hết các hạt a đều xuyên thẳng qua lá vàng, chứng tỏ nguyên tử có cấu tạo rỗng, ở tâm chứa một hạt nhân mang điện tích dương và có kích thước rất nhỏ so với kích thước nguyên tử.
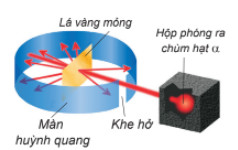
Hình 1.2. Thí nghiệm phát hiện hạt nhân nguyên tử
– Năm 1918, E. Rutherford và các cộng sự khi dùng hạt g bắn phá nitrogen đã phát hiện ra hạt proton.
– Năm 1918, E. Rutherford và các cộng sự khi dùng hạt a bắn phá nitrogen đã phát hiện ra hạt proton. Năm 1932, J. Chadwick (Chat-uých, người Anh), công sự của Rutherford, đã phát hiện ra hạt neutron khi bắn phá beryllium bằng các hạt c.
– Proton, neutron và electron là các hạt cấu tạo nên nguyên tử.
* Thành phần cấu tạo của nguyên tử gồm:
– Hạt nhân (nucleus): ở tâm của nguyên tử, chứa các proton mang điện tích dương và các neutron không mang điện.
– Vỏ nguyên tử chứa các electron mang điện tích âm, chuyển động rất nhanh xung quanh hạt nhân
Bảng 1.1. Khối lượng, điện tích của các loại hạt cấu tạo nên nguyên tử
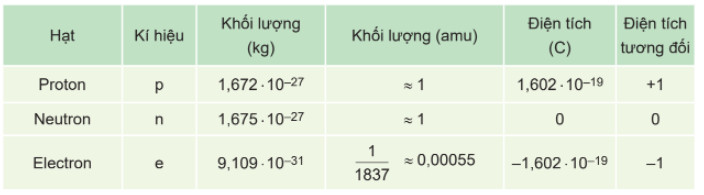
– Trong nguyên tử, số proton bằng số electron nên nguyên tử trung hoà điện.
– Khối lượng của electron rất nhỏ, không đáng kể so với khối lượng của proton hay neutron nên khối lượng của nguyên tử tập trung hầu hết ở hạt nhân.
| – Nguyên tử vô cùng nhỏ nhưng được tạo thành từ các hạt nhỏ hơn, gồm hạt nhân (chứa proton mang điện tích dương và neutron không mang điện) và vỏ nguyên tử (chứa các electron mang điện tích âm). Nguyên từ trung hoà về điện vì có số proton bằng số electron. |
|---|
1.2. Kích thước và khối lượng của nguyên tử
a. Kích thước
– Kích thước của nguyên tử là khoảng không gian tạo bởi sự chuyển động của các electron. Các nguyên tử khác nhau có số electron khác nhau nên có kích thước nhau. Nếu coi nguyên tử như một khối cầu thì đường kính của nó chỉ khoảng 10-10 m.
– Kích thước nguyên tử rất nhỏ nên thường được biểu diễn bằng đơn vị picomet (pm) hay Angstrom (\(\mathop A\limits^0 \)). 1 pm = 10-12 m, 1\(\mathop A\limits^0 \)= 10-10 m. Nguyên tử hydrogen có cũng chứa số nguyên bán kính khoảng 53 pm,
– Hạt nhân nguyên tử có đường kính khoảng 10-2 pm, kích dung được. Ví dụ: trong thước nhỏ hơn nhiều so với kích thước nguyên tử.
b. Khối lượng
– Khối lượng nguyên tử bằng tổng khối lượng các hạt proton, neutron và electron có trong nguyên tử. Khối lượng nguyên tử rất nhỏ nên một lượng chất rất nhỏ cũng chứa tới hàng tỉ tỉ nguyên tử. Ví dụ: Trong 2g carbon chứa khoảng 1023 nguyên tử carbon.
– Có thể biểu thị khối lượng nguyên tử theo đơn vị khối lượng nguyên tử, kí hiệu amu.
Ví dụ: Một nguyên tử oxygen có khối lượng là 2,656.10-26 kg.
1 amu = 1,661.10-27 kg nên khối lượng một nguyên tử oxygen là 15,990 amu.
| – Khối lượng nguyên tử tập trung ở hạt nhân (do khối lượng của electron rất nhỏ so với khối lượng của proton và neutron) |
|---|
1.3. Điện tích hạt nhân và số khối
– Số proton trong hạt nhân nguyên tử bằng số đơn vị điện tích hạt nhân, kí hiệu là Z.
Ví dụ: Hạt nhân nguyên tử Na có 11 proton nên số đơn vị điện tích hạt nhân là Z= 11.
– Tổng số proton và neutron trong hạt nhân của một nguyên tử được gọi là số khối (hay số nucleon), kí hiệu là A.
A = Z + số neutron
Ví dụ: Hạt nhân nguyên tử Na có số proton là 11 và số neutron là 12 nên số khối của hạt nhân nguyên tử Na là:
A = 11 + 12 = 23
|
– Hạt nhân nguyên tử có kích thước vô cùng nhỏ so với nguyên tử. |
|---|