1.1. Liên kết hóa học
– Tìm hiểu sự hình thành liên kết hóa học
– Trong hóa học, liên kết hóa học là lực, giữ cho các nguyên tử cùng nhau trong các phân tử hay các tinh thể.
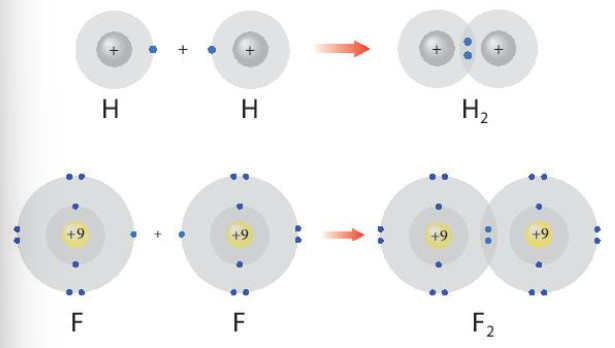
Hình 8.1. Sự hình thành các phân tử hydrogen và flurione
– Phần tử được tạo nên từ các nguyên tử bằng các liên kết hoá học.
1.2. Quy tắc Octet
– Tìm hiểu cách vận dụng quy tắc octet trong sự hình thành phân tử nitrogen (N2)
+ Để đạt cấu hình electron bền vững của các khí hiểm gần nhất, nguyên tử của các nguyên tố có xu hướng nhường hoặc nhận thêm, hoặc góp chung các electron hoá trị với các nguyên tử khác khi tham gia liên kết hoá học.
+ Ví dụ, liên kết giữa 2 nguyên tử nitrogen (N) trong phân tử nitrogen (N2) được tạo thành do mỗi nguyên tử nitrogen đã góp chung 3 electron hoá trị, tạo nên 3 cặp electron chung như Hình 8.2.
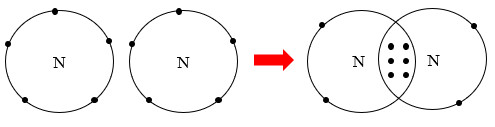
Hình 8.2. Sự hình thành liên kết trong phân tử nitrogen
– Tìm hiểu cách vận dụng quy tắc Octet trong sự hình thành ion dương, ion âm
+ Nguyên tử sodium có 1 electron ở lớp ngoài cùng. Nếu mất đi 1 electron này, nguyên tử sodium sẽ đạt được cấu hình electron bền vững sau:
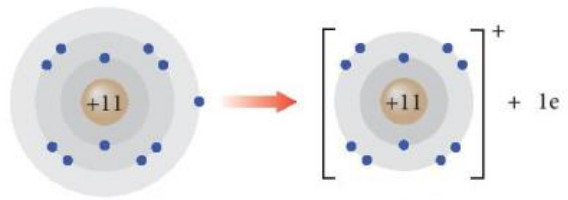
Nguyên tử sodium (Na) lon sodium (Na+)
Hình 8.3. Sự hình thành ion Na+
+ Phần tử thu được mang điện tích dương, gọi là ion sodium, kí hiệu Na+.
+ Tương tự, nguyên tử fluorine có 7 electron ở lớp ngoài cùng. Khi nhận vào 1 electron, nguyên tử fluorine sẽ đạt được cấu hình electron bền vững sau:
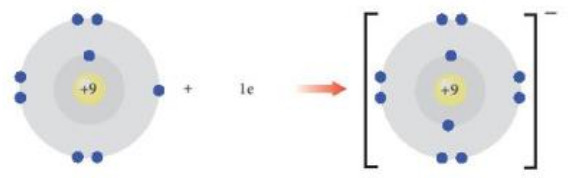
Nguyên tử fluorine (F) Ion fluoride (F–)
Hình 8.4. Sự hình thành ion F–
+ Phần tử thu được mang điện tích âm, gọi là ion fluoride, kí hiệu F–.
+ Không phải trong mọi trường hợp, nguyên tử của các nguyên tố khi tham gia liên kết đếu tuân theo quy tắc Octet.
+ Người ta nhận thấy một số phân tử có thể không tuân theo quy tắc Octet. Ví dụ: NO, BH3, SF6…
+ Với nguyên tử của các nguyên tố nhóm B, người ta áp dụng một quy tắc khác, tương ứng với quy tắc Octet, là quy tắc 18 electron để giải thích xu hướng khi tham gia liên kết hoá học của chúng.
| Quy tắc Octet (bát tử): Trong quá trình hình thành liên kết hoá học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium). |
|---|