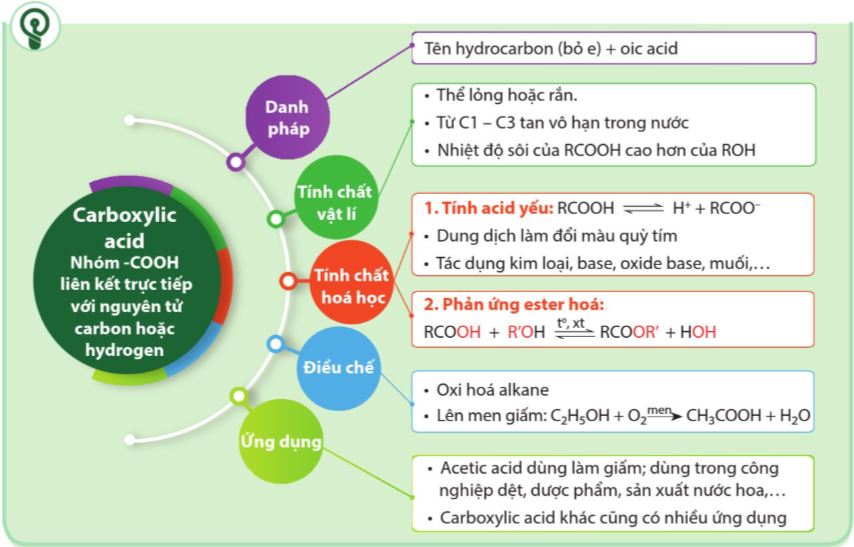
1.1. Khái niệm và danh pháp
a. Khái niệm
|
Carboxylic acid là các hợp chất hữu cơ trong phân tử có nhóm –COOH liên kết với nguyên tử carbon (trong gốc hydrocarbon hoặc COOH) hoặc nguyên tử hydrogen. |
– Công thức chung của carboxylic acid đơn chức, no, mạch hở: CnH2n+1COOH (n ≥0).
– Carboxylic acid trong phân tử có 1 nhóm -COOH gọi là monocarboxylic acid hay còn gọi là acid hữu cơ đơn chức.
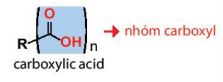
– Công thức của các carboxylic acid đơn chức thường được viết ở dạng thu gọn là RCOOH.
Ví dụ: CH3COOH, CH2=CHCOOH, C2H5COOH.
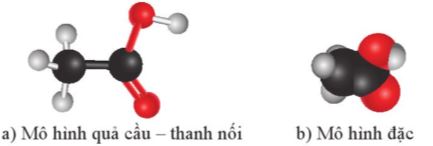
Hình 19.1. Mô hình phân tử acetic acid (ethanoic acid)
b. Danh pháp
Bảng 19.1. Tên thay thế, tên thông thường và tính chất vật lí của một số carboxylic acid thường gặp
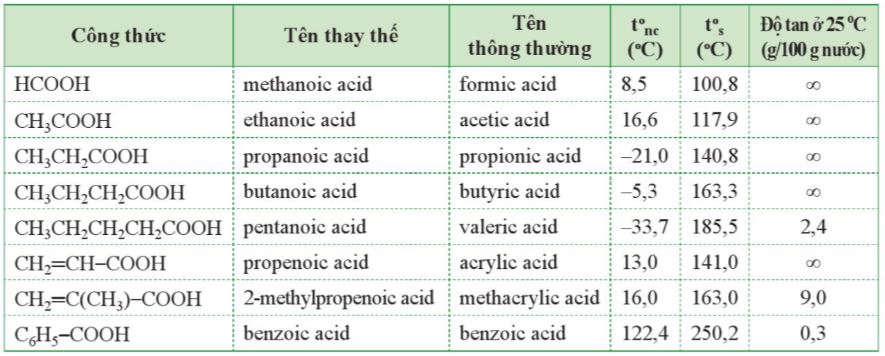
– Tên theo danh pháp thay thế của carboxylic acid đơn chức, mạch hở:
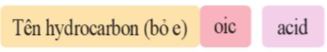
– Mạch chính là mạch carbon dài nhất chứa nhóm -COOH.
– Đánh số nguyên tử carbon của nhóm -COOH là 1.
– Tên thông thường của carboxylic acid thường xuất phát từ nguồn gốc tìm ra chúng trong tự nhiên.
1.2. Tính chất vật lí
– Phân tử carboxylic acid chứa nhóm carboxyl phân cực. Các phân tử carboxylic acid liên kết hydrogen với nhau tạo thành dạng dimer hoặc dạng liên phân tử.
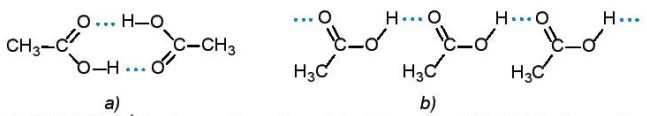
Hình 19.2. Liên kết hydrogen dạng dimer (a) và dạng liên phân tử (b) của acetic acid
– Do vậy, carboxylic acid có nhiệt độ sôi cao hơn so với hydrocarbon, alcohol, hợp chất carbonyl có phân tử khối tương đương.
– Carboxylic acid mạch ngắn là chất lỏng ở nhiệt độ phòng, carboxylic acid mạch dài là chất rắn dạng sáp.
– Carboxylic acid thường có mùi chua nồng, mỗi carboxylic acid có một vị chua riêng biệt.
– Carboxylic acid mạch ngắn tan tốt trong nước. Khi tăng số nguyên tử carbon trong gốc hydrocarbon thì độ tan của các carboxylic acid giảm.
1.3. Tính chất hoá học
a. Tính acid
– Trong dung dịch nước, carboxylic acid phân li không hoàn toàn theo cân bằng:

– \({K_a} = \frac{{{\rm{[}}RCO{O^ – }{\rm{][}}{H^ + }{\rm{]}}}}{{{\rm{[}}RCOOH]}}\)
– Hằng số cân bằng của phương trình phân li một số carboxylic acid được cho trong Bảng 24.3,
Bảng 19.2. Giá trị Ka của một số carboxylic acid

– Trong dung dịch nước, chỉ một phần nhỏ carboxylic acid phân li thành ion, vì vậy carboxylic acid là những acid yếu. Chúng thể hiện đầy đủ tính chất của acid.
Ví dụ:
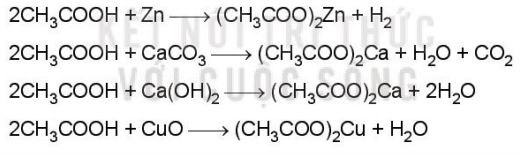
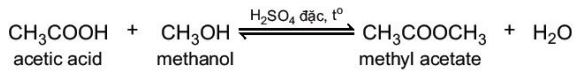
b. Phản ứng ester hoá
– Carboxylic acid phản ứng với alcohol tạo thành ester và nước theo phản ứng:
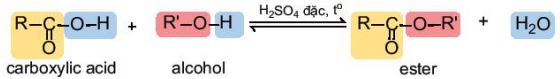
– Phản ứng giữa carboxylic acid và alcohol được gọi là phản ứng ester hoá. Phản ứng có đặc điểm thuận nghịch và thường dùng sulfuric acid đặc làm xúc tác.
Ví dụ:
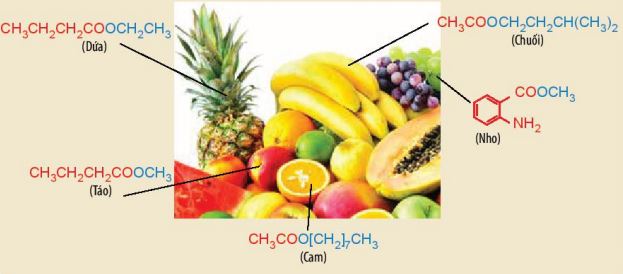
– Nhiều hợp chất ester tạo nên mùi hương đặc trưng của các loại hoa quả.
Ví dụ:
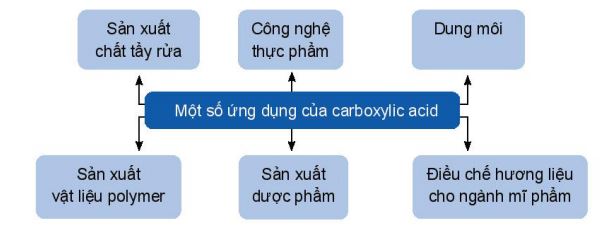
1.4. Ứng dụng và điều chế
a. Ứng dụng
b. Điều chế
Phương pháp lên men giấm
– Phương pháp lên men được sử dụng từ thời xa xưa để làm giấm.
– Nguyên liệu thường là các loại rượu như rượu gạo, rượu táo, rượu vang,…
– Quá trình lên men nhờ vi khuẩn acetobacter (men giấm) chuyển hoá ethanol thành acetic acid bởi oxygen không khí.
Ví dụ: C2H5OH + O2 \(\xrightarrow{men\,giấm}\) CH3COOH + H2O
Trong công nghiệp, người ta cung cấp thêm oxygen để tăng tốc độ phản ứng lên men.
Phương pháp oxi hoá alkane
Các alkane bị oxi hoá cắt mạch tạo thành các acid:
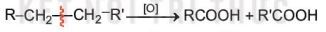
Ví dụ: 2CH3CH2CH2CH3 + 5O2 \(\xrightarrow{xúc\,tác,\,{{t}^{0}},\,p}\) 4CH3COOH + 2H2O